
| A. | 同温同压下两种气体的体积之比等于摩尔质量之比 | |
| B. | 同温同压下两种气体的物质的量之比等于密度之比 | |
| C. | 同温同压下两种质量相同的气体其体积比之比等于摩尔质量之比 | |
| D. | 同温同体积下两种气体的物质的量之比等于压强之比 |
分析 依据PV=nRT、n=$\frac{m}{M}$判断.
解答 解:A.依据PV=nRT可知,温度、压强一定条件下,V与n成正比,所以同温同压下两种气体的体积之比等于物质的量之比,故A错误;
B.依据PV=nRT、n=$\frac{m}{M}$,得PM=ρRT,温度、压强一定条件下,密度与摩尔质量成正比,故B错误;
C.依据PV=nRT、n=$\frac{m}{M}$,得PV=$\frac{m}{M}$RT,可知温度、压强、质量一定条件下,气体体积与摩尔质量成反比,所以同温同压下两种质量相同的气体其体积比之比等于摩尔质量之比倒数,故C错误;
D.依据PV=nRT,可知温度、体积一定条件下,P与n成正比,即同温同体积下两种气体的物质的量之比等于压强之比,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗定律及推论,明确PV=nRT、n=$\frac{m}{M}$是解题关键,题目难度中等,注意对相关公式的推导.


科目:高中化学 来源: 题型:选择题
| A. | 胶体区别与其他分散系的本质特征是分散质的粒子直径在1-100nm之间 | |
| B. | 用平行光照射CuSO4溶液和氢氧化铁胶体,不可以加以区分 | |
| C. | 胶体是纯净物 | |
| D. | 树林中的晨曦,该现象与丁达尔效应无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
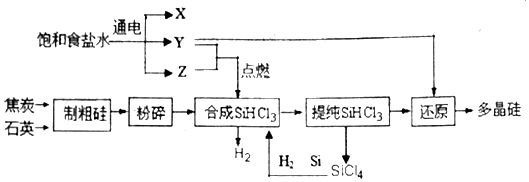
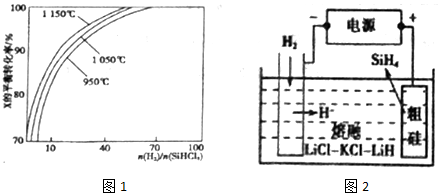
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ②⑦ | C. | ①③ | D. | ⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与稀盐酸的反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 氢氧化钡与稀硫酸的反应:Ba2++SO42-═BaSO4↓ | |
| C. | 铜溶于浓硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | 将小苏打加入到氢氧化钠溶液中:OH-+HCO3-═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
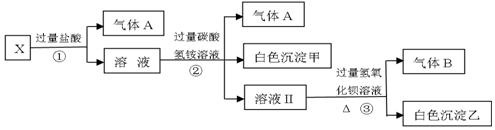
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 酸 | H2C2O4 | HF | H2CO3 | H3BO3 |
| 电离平衡常数Ka | Ka1=5.9×10-2 Ka2=6.4×10-5 | 未知 | Ka1=4.2×10-7 Ka2=5.6×10-11 | 5.8×10-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 19:8 | B. | 22:1 | C. | 13:8 | D. | 8:13 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只要参加反应的Na2O2的物质的量一定,反应生成的氧气的量就一定 | |
| B. | 只要CO2和H2O(g)的中的物质的量一定,反应所消耗的Na2O2的量就一定 | |
| C. | 只要混合气体的总的物质量一定,反应中所转移的电子的物质的量就一定 | |
| D. | 只要混合气体的总的物质的量一定,固体所增加的质量就一定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com