
| ||
| 0.01mol |
| 1L |
| 1×10 -14 |
| 0.01 |


科目:高中化学 来源: 题型:
海水资源的利用具有非常广阔的前景。
(1)海水淡化的主要方法有(只写出1种即可) 。
(2)海水中丰富的氯化钠是重要的化工原料,如电解饱和食盐水可以制备多种化工产品。
①用石墨电极电解饱和食盐水时,阳极的电极反应式是 。
②常温下,用石墨电极电解饱和食盐水,当阴极产生的气体体积为112 mL(已折算为标准状况)时停止电解,此时溶液体积为1 L,若忽略气体的溶解,最终溶液的pH约为 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:北京期末题 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:
海洋是个巨大的资源宝库,海水资源的利用具有非常广阔的发展前景。海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如下图:
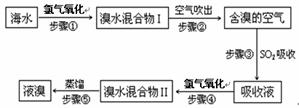
(1)步骤①反应的离子方程式为 。
(2)步骤③反应的化学方程式为 。
(3)Br的原子序数是 ,在周期表中位于第 周期、第 族。
(4)步骤⑤蒸馏的过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,请解释原因 。
(5)为什么不直接用“溴水混合物I”而要用“溴水混合物II”进行蒸馏,得到液溴?
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com