
【题目】X、Y、Z、M、Q五种短周期元素,原子序数依次增大。Y元素的最高正价为![]() 价,Y元素与Z、M元素相邻,且与M元素同主族;化合物
价,Y元素与Z、M元素相邻,且与M元素同主族;化合物![]() 的电子总数为18个;Q元素的原子最外层电子数比次外层少一个电子。下列说法不正确的是( )
的电子总数为18个;Q元素的原子最外层电子数比次外层少一个电子。下列说法不正确的是( )
A. 原子半径:![]()
B. 最高价氧化物对应水化物的酸性:![]()
C. ![]() 易溶于水,其水溶液呈碱性
易溶于水,其水溶液呈碱性
D. X、Z和Q三种元素形成的化合物一定是共价化合物
【答案】D
【解析】
X、Y、Z、M、Q为五种短周期元素,原子序数依次增大。Y元素的最高正价为+4价,则证明该元素为第IVA族元素,又知Y元素与Z、M元素相邻,且与M同族,则在元素周期表位置应为
IVA族 | VA族 |
Y | Z |
M |
,故推知Y为C元素,Z为N元素,M为Si元素;化合物Z2X4的电子总数为18,则推知,X为H,该化合物为N2H4;Q元素的原子最外层电子总数比次外层电子数少一个电子,推出Q为Cl元素,据此结合元素周期律与物质的结构与性质分析作答。
根据上述分析可知,X为H、Y为C元素、Z为N元素、M为Si元素、Q为Cl元素,则
A. 同周期元素从左到右原子半径依次减小,同主族元素从上到下原子半径依次增大,则原子半径比较:Z(N)<Y(C)<M(Si),故A正确;
B. 同周期元素从左到右元素非金属性依次增强,同主族元素从上到下元素非金属性依次减弱,因元素的非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性:Z(N)>Y(C)>M(Si),则最高价氧化物对应水化物的酸性:Z(N)>Y(C)>M(Si),故B正确;
C. N2H4的结构简式可表示为H2N-NH2,分子中含两个氨基,可与酸反应,具有碱性,且该分子具有极性,与水分子间也存在氢键,根据相似原理可知,N2H4易溶于水,故C正确;
D. X、Z和Q三种元素组成的化合物有很多,不一定都是共价化合物,如氯化铵属于铵盐,为离子化合物,故D错误;
答案选D。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】三氧化二镍(Ni2O3)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取Ni2O3.已知草酸的钙、镁、镍盐均难溶于水。工艺流程图如图所示:
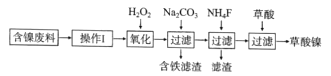
回答下列问题:
(1)“操作I”为“酸浸”,为了提高酸浸的效率,可以采取的措施为__________(写出两条)。
(2)加入H2O2发生的主要反应的离子方程式为________________
(3)加入碳酸钠溶液调pH至4.0~5.0,其目的是___________________
(4)将草酸镍(NiC2O4·2H2O)在热空气中干燥脱水,再采用高温煅烧,可制得Ni2O3,同时获得混合气体,该混合气体的主要成分为水蒸气和_________________
(5)工业上还可用电解法制取Ni2O3用NaOH溶液调 NiCl2,溶液的pH至7.5,加入适量Na 2SO4后利用惰性电极电解。电解过程中产生的Cl2,有80%在弱碱性条件下生成CIO-,再把二价镍氧化为三价镍。CIO-氧化Ni(OH)2生成Ni2O3的离子方程式为_______________________amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量为_______mol.
(6)以Al和NiO(OH)为电极,NaOH溶液为电解液组成原电池,放电时NiO(OH)转化为Ni(OH)2,则放电时负极的电极反应式为_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B两种常见金属元素的相对原子质量之比是8∶9。将两种金属单质按物质的量之比为3∶2组成1.26g混合物。将此混合物与足量稀硫酸反应,放出1.344L(标准状况)氢气。若这两种金属单质在反应中生成氢气的物质的量相等,求A、B两金属的摩尔质量各为多少___?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核电荷数小于18的某元素X,其原子核外电子层数为a,最外层电子数为(2a+l)。下列有关元素X的说法中,不正确的是()
A. 元素X的原子核内质子数可能为(2a2-l)
B. 元素X形成的单质既能作氧化剂又能作还原剂
C. 元素X形成的简单离子,各电子层的电子数均达到2n2个(n表示电子层数)
D. 由元素X形成的某些化合物,可能具有杀菌消毒的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_____、_____(填标号)。
A. B.
B.
C.![]() D.
D.![]()
(2)Li+与H具有相同的电子构型,r(Li+)小于r(H),原因是______。
(3)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是______、中心原子的杂化形式为______。LiAlH4中,存在_____(填标号)。
A.离子键 B.σ键 C.π键 D.氢键
(4)Li2O是离子晶体,其晶格能可通过图(a)的BornHaber循环计算得到。
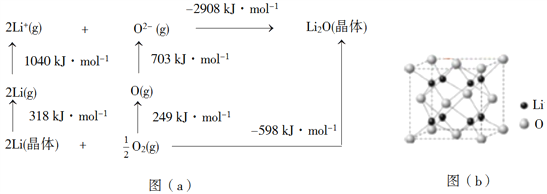
可知,Li原子的第一电离能为________kJ·mol1,O=O键键能为______kJ·mol1,Li2O晶格能为______kJ·mol1。
(5)Li2O具有反萤石结构,晶胞如图(b)所示。已知晶胞参数为0.4665 nm,阿伏加德罗常数的值为NA,则Li2O的密度为______g·cm3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 溶液与
溶液与![]() 溶液发生反应:
溶液发生反应:![]() ,达到平衡。下列说法不正确的是( )
,达到平衡。下列说法不正确的是( )
A. 加入苯,振荡,平衡正向移动
B. 经苯2次萃取分离后,在水溶液中加入![]() ,溶液呈血红色,表明该化学反应存在限度
,溶液呈血红色,表明该化学反应存在限度
C. 加入![]() 固体,平衡逆向移动
固体,平衡逆向移动
D. 该反应的平衡常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知KMnO4与浓HCl在常温下反应能产生Cl2。若用下图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中错误的是( )

A.只有①和②处B.只有②处C.只有②和③处D.只有②③④处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g) + 4NH3(g) ![]() 5N2(g) +6H2O(g)。
5N2(g) +6H2O(g)。
①能说明该反应已达到平衡状态的标志是_______
a.反应速率![]() ( NH3) =
( NH3) =![]() ( N2)
( N2)
b.容器内压强不再随时间而发生变化
c.容器内N2的物质的量分数不再随时间而发生变化
d.容器内n(NO)∶n(NH3)∶n(N2)∶n(H2O) = 6∶4∶5∶6
②某次实验中测得容器内NO及N2的物质的量随时间变化如图所示,图中b点对应的速率关系是![]() (正)____
(正)____![]() (逆)(填“﹥”、“﹤”或“﹦”),d点对应的速率关系是
(逆)(填“﹥”、“﹤”或“﹦”),d点对应的速率关系是![]() (正)____
(正)____![]() (逆)(填﹥、﹤或﹦)。
(逆)(填﹥、﹤或﹦)。

(2)298 K时,若已知生成标准状况下2.24 L NH3时放出热量为4.62 kJ。写出合成氨反应的热化学方程式_______。在该温度下,取1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量总小于92.4 kJ,其原因是________。
(3)一定条件下,在2 L密闭容器内,反应2NO2(g)![]() N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |