
| A、在石油中添加的脱硫剂是石灰石 |
| B、由于硫可溶于CS2,但我们也可以用CS2溶剂溶解煤中的硫,进而实现煤脱硫 |
| C、脱硫后产生的废料中含有的CaCO3,可用于制造建筑材料 |
| D、国际上最新采用“饱和亚硫酸钠溶液吸收法”,其反应为:Na2SO3+SO2+H2O=2NaHSO3 |
| ||
| ||
| ||


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强碱性溶液中:Na+、K+、SO42-、AlO2- |
| B、强酸性溶液中:K+、Fe3+、Cl-、SCN- |
| C、某无色溶液中:H+、Fe2+、NH4+、NO3- |
| D、与铝反应生成H2的溶液中:Na+、Mg2+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
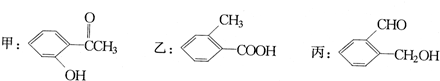
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
| D、无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com