
甲、乙、丙、丁4中物质分别含2种或3种元素,它们的分子中各含18个电子.甲是气态氢化物,在水中分步电离出两种阴离子.下列推断合理的是( )
|
| A. | 某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应 |
|
| B. | 乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键 |
|
| C. | 丙中含有二周期IVA族的元素,则丙一定是甲烷的同系物 |
|
| D. | 丁和甲中各元素质量比相同,则丁中一定含有﹣1价的元素 |
| 无机物的推断;极性键和非极性键;芳香烃、烃基和同系物. | |
| 专题: | 推断题. |
| 分析: | 甲是18电子的氢化物,且其水溶液为二元弱酸,不难得出甲为H2S,乙与氧气的摩尔质量相同,可能为CH3 OH、N2H4等符合,丙中含有二周期IVA族的元素,可能为CH3 OH,丁和甲中各元素质量比相同,应为H2O2,结合各物质的结构和性质解答该题. |
| 解答: | 解:A.甲是18电子的氢化物,且其水溶液为二元弱酸,不难得出甲为H2S,某钠盐溶液若为NaHS溶液,其中含有HS﹣、OH﹣,但NaHS既能与盐酸等反应生成H2S,也能与Na0H反应生成Na2S,故A错误; B.氧气的摩尔质量为32g/mol,乙的摩尔质量也为32g/mol,且含有18电子,CH3 OH符合,CH3 OH中只含有极性键无非极性键,故B错误; C.第二周期IVA族元素为C,如CH3 OH符合,但CH3 OH不是CH4的同系物,故C错误; D.H2S中元素的质量比为1:16,H2O2分子中元素的质量比也为1:16,H2O2中氧元素的价态为一1价,故D正确. 故选D. |
| 点评: | 本题考查无机物的推断,题目难度较大,注意常见18电子物质的种类以及性质,解答本题时注意能找出反例. |


科目:高中化学 来源: 题型:
下列离子方程式正确的是
A.用氢氧化钠溶液吸收二氧化氮:2OH-+2NO2=== +NO↑+H2O
+NO↑+H2O
B.碳酸氢钠溶液与过量的澄清石灰水反应: +Ca2++2OH-===CaCO3↓+
+Ca2++2OH-===CaCO3↓+ +2H2O
+2H2O
C.浓盐酸酸化的KMnO4溶液与H2O2反应: +6H++5H2O2===2Mn2++5O2↑+8H2O
+6H++5H2O2===2Mn2++5O2↑+8H2O
D.硫酸氢钠溶液与足量氢氧化钡溶液混合:H++ +Ba2++OH-===BaSO4↓+H2O
+Ba2++OH-===BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
已知同温同压下,下列反应的焓变和平衡常数分别表示为
H2(g)+ O2(g)=H2O(g)△H1 K1
O2(g)=H2O(g)△H1 K1
 N2(g)+O2(g)=NO2(g)△H2 K2
N2(g)+O2(g)=NO2(g)△H2 K2
 N2(g)+
N2(g)+ H2(g)=NH3(g)△H3 K3
H2(g)=NH3(g)△H3 K3
则反应2NH3(g)+ O2(g)=2NO2(g)+3H2O(g)的△H和K分别为( )
O2(g)=2NO2(g)+3H2O(g)的△H和K分别为( )
|
| A. | 2△H1+2△H2﹣2△H3 3K1+2K2﹣2K3 |
|
| B. | 2△H3﹣3△H1﹣2△H2 |
|
| C. | 3△H1+2△H2﹣2△H3 |
|
| D. | 3△H1+2△H2﹣2△H3 3K1+2K2﹣2K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列图示与对应的叙述相符的是( )
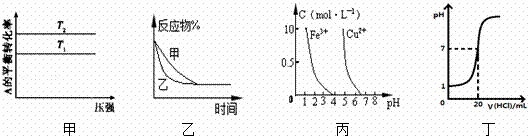
|
| A. | 图甲可以判断出反应A(g)+B(g)⇌若2C(g)的△H<0,T2>T1 |
|
| B. | 图乙表示压强对可逆反应2A(g)+2B(g)⇌3C(g)+D(s)的影响.乙的压强比甲的压强大 |
|
| C. | 依据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量CuO,调节pH≈4 |
|
| D. | 图丁表示25℃时,用0.1 mol/L叫盐酸滴定20 mL 0.1 mol/L NaOH溶液,溶液的pH随加入盐酸体积的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在温度T℃下,某Ba(OH)2稀溶液中c(H+)=10﹣amol/L,c(OH﹣)=10﹣bmol/L,已知a+b=12,向该溶液中逐滴加入NaHSO4溶液,测得混合溶液的部分PH如下表所示:
| 序号 | 氢氧化钡的体积/mL | 硫酸氢钠的体积/mL | 溶液的PH |
| ① | 33.00 | 0.00 | 8 |
| ② | 33.00 | X | 7 |
| ③ | 33.00 | 33.00 | 6 |
(1)依据题意判断,T℃ 大于 25℃(填“大于”、“小于”或“等于”)
(2)b= 4 ,X= 27
(3)反应③的离子方程式为: Ba2++2OH﹣+2H++SO42﹣=BaSO4↓+2H2O
(4)将此温度下的Ba(OH)2溶液取出1mL,加水稀释至1L,则稀释后溶液中c(Ba2+):c(OH﹣) 1:20 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式书写正确的是( )
|
| A. | 2SO2+O2 |
|
| B. | C(s)+O2(g)═CO2(g)△H=+393.5 kJ/mol |
|
| C. | 500℃、30MPa下,将0.5mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) |
|
| D. | 2.00gC2H2气体完全燃烧生成液态水和二氧化碳气体,放出99.6kJ的热量,该反应的热化学方程式为:2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣2589.6kJ/moL |
查看答案和解析>>
科目:高中化学 来源: 题型:
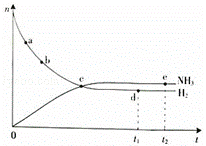
合成氨工业对国民经济和社会发展具有重要的意义.根据已学知识回答下列问题:
(1)对于密闭容器中的反应:N2(g)+3H2(g)═2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如右下图所示.
下列叙述正确的是 (填选项).
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大
(2)已知N2(g)+3H2 (g)═2NH3(g)△H=﹣92.4kJ•mol﹣1
①合成氨工业采取的下列措施不可用平衡移动原理解释的是 (填选项).
A.采用较高压强(20MPa~50MPa)
B.采用500℃的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来
②合成氨工业中采用了较高压强(20MPa~50MPa),而没有采用100MPa或者更大压强,试解释没有这么做的理由 .
③在容积均为2L(容器体积不可变)的甲、乙两个容器中,分别加入2molN2、6molH2和1molN2、3molH2,在相同温度、催化剂下使其反应.最终达到平衡后,两容器N2转化率分别为α甲、α乙,则甲容器中平衡常数表达式为 (用含α甲的代数式表示,化简为最简式),此时α甲 α乙(填“>”、“<”“=”).
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物A(化学式为C4H8O3)在一定条件下的性质有:在浓硫酸存在下,可脱水生成能使溴水褪色的只有一种结构形式的有机物B;在浓硫酸存在下,能分别与乙醇或乙酸反应生成有机物C或D;在浓硫酸存在下,还能生成分子式为C8H12O4的六元环状有机物E。则下列有关叙述一定正确的( )
A.有机物A的名称为α—羟基丁酸 B.有机物B的结构简式可能为CH3CH=CHCOOH
C.有机物C和D属同分异构体 D.环状有机物E的结构只有一种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com