
【题目】下列关于金属元素特征的叙述,正确的是
A. 金属元素的原子只有还原性,离子只有氧化性
B. 金属元素在化合物中一定显正价
C. 金属单质都可以和酸反应置换出氢气
D. 金属元素的单质在常温下均为固体
科目:高中化学 来源: 题型:
【题目】下列事实与对应的方程式不符合的是
A. 自然界中正常的雨水呈酸性:H2O+CO2![]() H2CO3 ,H2CO3
H2CO3 ,H2CO3![]() H++HCO3—
H++HCO3—
B. “NO2球”浸泡在冷水中,颜色变浅:2NO2(g) (红棕色)![]() N2O4 (g) (无色) ΔH<0
N2O4 (g) (无色) ΔH<0
C. 甲烷的燃烧热为-890.3 kJ·mol—1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
D. 硫代硫酸钠溶液与稀硫酸混合出现浑浊:S2O32-+2H+=S +SO2 +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验验证元素周期律。
Ⅰ.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成元素氮、碳、硅非金属性强弱比较的实验研究。已知A是强酸,B是块状固体。打开分液漏斗的活塞后,可看到有大量气泡产生,烧杯中可观察到白色沉淀生成。
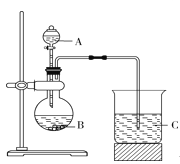
(1)甲同学设计实验的理论依据是_________________。
(2)写出选用的物质:A____________,B____________,C________(填化学式)。
(3)烧杯中反应的离子方程式为______________________。
(4)乙同学认为甲同学设计的实验不够严谨,应在B和C之间增加一个洗气装置,该装置中应盛放________(填试剂名称)溶液,目的是_____________________。
Ⅱ.丙同学设计了如图装置来验证卤族元素性质的递变规律。A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。
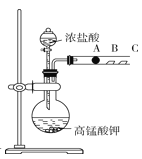
(5)A处的实验现象为_________;写出B处反应的离子方程式:____________;向NaBr和KI的混合溶液中,通入足量的Cl2充分反应后,将所得溶液蒸干并灼烧,最后得到的物质是_________。
(6)丙同学利用此实验证明卤素单质氧化性Cl2>Br2>I2,你认为此实验_____(填“合理”或“不合理”),理由是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】总的物质的量为0.50mol的Fe粉与Al粉混合物分为等质量的两份;在一份中加入足量的稀盐酸,在标准状况下产生气体aL;在另一份中加入足量的氢氧化钠溶液,在标准状况下产生气体bL。则a+b的数值不可能是( )
A. 5.6 B. 7.3 C. 8.2 D. 11.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用Na2SO4溶液沉淀Ba2+、Pb2+、Ca2+三种金属离子(M2+),所需SO42-最低浓度的对数值p(SO42-)=-lgc(SO42-)与p(M2+)=-lgc(M2+)关系如图所示。下列说法正确的是

A. KSP(CaSO4)<KSP(PbSO4)<KSP(BaSO4)
B. a点可表示CaSO4的饱和溶液,且c(Ca2+)=c(SO42-)
C. b点可表示PbSO4的不饱和溶液,且c(Pb2+)<c(SO42-)
D. 向Ba2+浓度为10-5mol·L-1的废水中加入CaSO4粉末,会有BaSO4沉淀析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是_________(从下列仪器中选出所需的仪器,用标号字母填写空白处)。
A.烧杯
B.坩埚
C.表面皿
D.泥三角
E.酒精灯
F.干燥器
(2)步骤③的实验操作名称是 ;步骤⑥的目的是从含碘的苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。
(3)步骤④反应的离子方程式是 。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是 。
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ:为使空气质量达标,完成二氧化硫,氮氧化物排放量下降的目标,离不开各种化学处理方法。一定条件下,用CO处理燃煤烟气中的SO2可生成液态硫,实现硫的回收。
己知:2CO(g)+O2(g)![]() 2CO2(g)△H=-566kJ·mol-1
2CO2(g)△H=-566kJ·mol-1
S(l)+O2(g)![]() SO3(g)△H=-296kJ·mol-1
SO3(g)△H=-296kJ·mol-1
则用CO处理燃煤烟气中SO2的热化学方程式是___________________。
Ⅱ:如图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。根据要求回答相关问题:
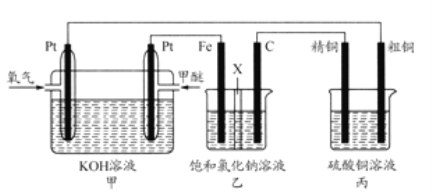
(1)甲醚燃料电池的负极反应式____________。
(2)石墨电极(C)的电极反应式为____________________________________。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将____________(填“增大”“减小”或“不变”)。
(4)若在标准状况下,有2.24L氧气参加反应,丙装置中阴极析出铜的质量为____________;则乙装置中生成标况下气体的体积为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4) 是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:

(1)反应①应在温度较低的情况下进行(因在温度较高时KOH 与Cl2 反应生成的是KClO3。)写出①的化学方程式_____________________。
(2)在溶液I中加入KOH 固体的目的是_____________________。(填编号)
A.与反应液I中过量的Cl2继续反应,生成更多的KClO
B.KOH 固体溶解时会放出较多的热量,有利于反应进行
C.为下一步反应提供碱性的环境
D.使KClO3 转化为KClO
(3)从溶液Ⅱ中分离出K2FeO4 后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为__________________________________________。
(4)如何判断K2FeO4 晶体已经洗涤干净___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com