
 1L某混合溶液,可能含有的离子如表:
1L某混合溶液,可能含有的离子如表:| 可能大量含有的阳离子 | H+、NH+、Al3+、K+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、ClO-、AlO2- |
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | a mol | 0 | 0 |
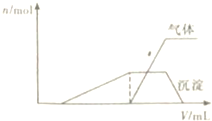
分析 (1)根据产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(V)的关系的图示可以知道,一开始无沉淀,溶液中一定含有H+,能够与氢离子反应的离子不能存在;加NaOH有气体放出,则推断溶液中一定含有NH4+,沉淀最后完全消失,则溶液中只含有Al3+,不同金属阳离子灼烧呈现不同的焰色,据此解答;
(2)碘离子与溴离子的还原性强弱顺序为:I->Br-,加入氯气2.8L时溶液中I-amol,则说明通入2.8LCl2只发生:Cl2+2I-═I2+2Cl-,2.8L变成5.6L,消耗2.8L Cl2的物质的量为$\frac{2.8L}{22.4L/mol}$=0.125mol,先后发生:Cl2+2I-═I2+2Cl-,Cl2 +2Br-═Br2+2Cl-,根据反应方程式计算.
解答 解:(1)从产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(V)的关系的图示可以知道,开始时没有沉淀生成,说明溶液中氢离子,则一定没有ClO-、AlO2-;随后出现沉淀,且沉淀完全溶解了,说明沉淀是氢氧化铝,溶液中一定含有铝离子;氢氧化铝溶解前生成了气体,该气体一定是氨气,故溶液中一定含有铵离子;不能确定是否含有钾离子,可以通过灼烧溶液,透过蓝色的钴玻璃观察焰色确定钾离子的存在;
①则该溶液中一定不含有的离子是H+、NH4+、Al3+;故答案为:H+、NH4+、Al3+;
②可能存在的阳离子有K+;故答案为:K+;
③肯定不存在的阴离子是ClO-、AlO2-;故答案为:ClO-、AlO2-;
(2)①2.8L氯气的物质的量为$\frac{2.8L}{22.4L/mol}$=0.125mol,通入0.125mol氯气时溶液中有I-,所以Br-没有参加反应,所以溶液中n(Br-)=1.5mol,溶液中氯离子为通入氯气生成的和原来溶液中存在的,Cl原子守恒得原来n(Cl-)=1.25mol-0.125mol×2=1mol;通入0.25mol氯气时溶液中没有I-,则碘离子完全反应,且n(Br-)=1.4mol,说明有0.1mol溴离子参加反应,则碘离子完全反应,根据转移电子相等得n(I-)=0.25mol×2-0.1mol×1=0.4mol,根据反应:Cl2+2I-═I2+2Cl-,该反应中生成0.25mol氯离子消耗碘离子,所以a=0.5mol-0.25mol=0.15mol,故答案为:0.15;
②通过以上分析知,当通入Cl2的体积为3.36L即0.15mol(标准状态下)时,溶液中发生反应的离子方程式为Cl2+2I-=2Cl-+I2;n(Cl-)=1mol、n(Br-)=1.5mol、n(I-)=0.4mol,溶液体积相同,c(Br-)=$\frac{1.5mol}{2L}$=0.75mol/L,c(I-)=$\frac{1mol}{2L}$=0.5mol/L,
故答案为:Cl2+2I-=2Cl-+I2;0.75mol/L;0.5mol/L.
点评 本题考查离子的判断和有关计算,准确分析图标数据是解题关键,题目难度中等,注意根据离子的还原性以及表中数据判断反应的程度,结合方程式计算.


科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 氧化物 | 环境问题 | 主要来源 |
| A | CO2 | 破坏臭氧层 | 化石燃料的燃烧 |
| B | SO2 | 温室效应 | 汽车尾气的排放 |
| C | NO2 | 光化学烟雾 | 工厂废气的排放 |
| D | CO | 酸雨 | 汽车尾气和化石燃料的不完全燃烧 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
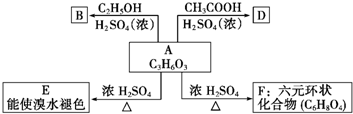
 A、B、C、D、E、F 六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F 六种物质的转化关系如图所示(反应条件和部分产物未标出).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.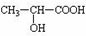 +CH3CH2OH $→_{△}^{浓硫酸}$
+CH3CH2OH $→_{△}^{浓硫酸}$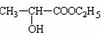 +H2O,
+H2O,查看答案和解析>>
科目:高中化学 来源: 题型:多选题
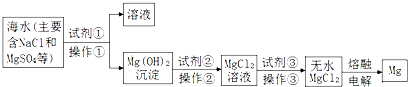
| A. | 试剂①可以选用的试剂是熟石灰,操作①的方法是过滤 | |
| B. | 试剂②可以选用的试剂是盐酸 | |
| C. | 操作③是直接将MgCl2溶液加热蒸发得到无水MgCl2晶体 | |
| D. | 无水MgCl2在通电时发生电离,电解后得到单质Mg. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向10ml0.1mol/L的Ca(ClO)2的溶液中鼓入标态下的SO2气体44.8ml:Ca2++2ClO-+2H2O+2SO2=CaSO4↓+2Cl-+4H++SO42- | |
| B. | 向98.3%的浓硫酸中加入铜片并加热:Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+2H2O+Cu2+ | |
| C. | 向NH4HCO3溶液中加足量浓NaOH溶液并加热:HCO3-+OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+CO32- | |
| D. | 用氯化铵和消石灰两种固体混合加热制氨气:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、CH3COO-、Cl- | B. | Mg2+、Ba2+、Br- | ||
| C. | Mg2+、Cl-、I- | D. | Na+、NH4+、Cu2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com