
 .
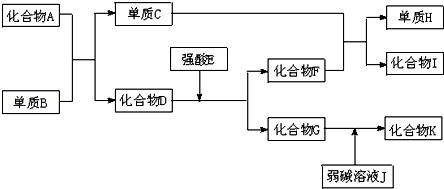
.分析 I是具有磁性的物质,应为Fe3O4,单质C与化合物F反应得到单质H与化合物I,由元素守恒可知C为Fe,D和K都具有两性,分别为氧化铝、氢氧化铝中的一种,单质B与化合物A反应得到Fe与D,该反应为铝热反应,可推知B为Al、A为Fe2O3、D为Al2O3,顺推可知F为H2O,G为AlCl3,H为H2,弱碱溶液J为氨水,K为Al(OH)3,据此解答.
解答 解:I是具有磁性的物质,应为Fe3O4,单质C与化合物F反应得到单质H与化合物I,由元素守恒可知C为Fe,D和K都具有两性,分别为氧化铝、氢氧化铝中的一种,单质B与化合物A反应得到Fe与D,该反应为铝热反应,可推知B为Al、A为Fe2O3、D为Al2O3,顺推可知F为H2O,G为AlCl3,H为H2,弱碱溶液J为氨水,K为Al(OH)3,
(1)由上述分析可知,D是Al2O3,H是H2,故答案为:Al2O3;H2;
(2)AlCl3溶液中铝离子水解:Al3++3H2O?Al(OH)3+3H+,破坏水的电离平衡,溶液呈酸性,故答案为:酸性;Al3++3H2O?Al(OH)3+3H+;
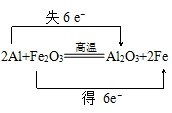
(3)A+B→D+C的反应为铝热反应,并用单线桥表示反应过程中电子转移的方向和数目为 ,
,
故答案为: ;
;
(4)G为AlCl3,J为氨水,反应的离子方程式Al3++3NH3•H2O=Al(OH)3+3NH4+,故答案为:Al3++3NH3•H2O=Al(OH)3+3NH4+.
点评 本题考查无机物推断,涉及Fe、Al元素化合物性质,“I是具有磁性的物质,D和K都具有两性”是推断突破口,再结合转化关系推断,需要学生熟练掌握元素化合物知识,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 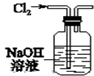 用图装置除去Cl2中混有的少量HCl | |
| B. | 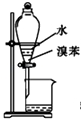 用图装置分离水和溴苯的混合物 | |
| C. | 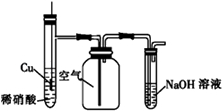 用图装置制备并收集NO气体 | |
| D. | 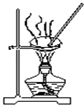 用图装置蒸干AlCl3饱和溶液制备AlCl3晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠与稀盐酸 | B. | 过氧化钠与二氧化碳 | ||
| C. | 氢氧化钠与二氧化碳 | D. | 钠与氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3、PH3、AsH3 | B. | SiH4、PH3、H2S | C. | HI、HBr、HCl | D. | H2S、HCl、AsH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属比非金属易失电子,所以金属可以置换非金属,而非金属不能置换金属 | |
| B. | 变价金属一定是过渡元素 | |
| C. | 不含金属元素的化合物也可能是离子化合物 | |
| D. | 显酸性的溶液中溶质只能是酸或强酸弱碱盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
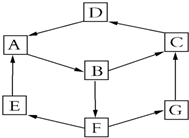 某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如图所示:
某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如图所示:| 纯A(单质) | B溶液 | D固体 | G溶液 | |
| 颜色 | 银白色 | 黄色 | 红棕色 | 浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 嫦娥一号 | 液氢(H2) | ①2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1 ②2H2(l)+O2(l)=2H2O(g)△H=-482.6kJ•mol-1 |
| 祥云火炬 | 丙烷 (C3H8) | ③C3H8(l)+5O2(g)=3CO2(g)+4H2O(g)△H=-2013.8kJ•mol-1 ④C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2221.5kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 过氧化氢和臭氧都是常见的绿色氧化剂,工业生产中有着重要用途.
过氧化氢和臭氧都是常见的绿色氧化剂,工业生产中有着重要用途.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂 | |
| B. | 上述反应中每生成2 mol AlN,N2得到3 mol | |
| C. | 氮化铝中氮元素的化合价为-3 | |
| D. | 氮化铝晶体属于分子晶体,熔点和沸点较低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com