
【题目】根据图1、图2、图3及题中信息,回答下列问题
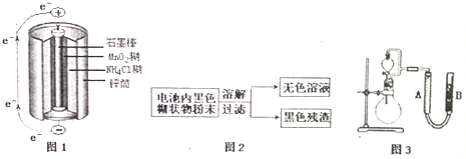
![]() 图1是锌锰干电池基本构造图,该电池的负极材料是 ______ ;工作时
图1是锌锰干电池基本构造图,该电池的负极材料是 ______ ;工作时![]() 离子在正极放电产生两种气体,其中一种气体分子是含
离子在正极放电产生两种气体,其中一种气体分子是含![]() 的微粒,正极的电极反应式是 ______ ;当电路中每通过
的微粒,正极的电极反应式是 ______ ;当电路中每通过![]() ,负极质量减少 ______ ;
,负极质量减少 ______ ;
![]() 图2是利用废旧锌锰干电池内的黑色糊状物分离得到黑色残渣
图2是利用废旧锌锰干电池内的黑色糊状物分离得到黑色残渣![]() 的流程图.该流程中溶解和过滤操作均要使用到的玻璃仪器有 ______ ;
的流程图.该流程中溶解和过滤操作均要使用到的玻璃仪器有 ______ ;
![]() 图3是探究
图3是探究![]() 在制
在制![]() 过程中的作用的实验装置图,利用该装置完成下表中实验一和实验二,实验过程中有关实验现象和所得数据如下表
过程中的作用的实验装置图,利用该装置完成下表中实验一和实验二,实验过程中有关实验现象和所得数据如下表![]() 已知:两次实验气体的体积在相同条件下测定:
已知:两次实验气体的体积在相同条件下测定:![]() 由分液漏斗滴入到圆底烧瓶
由分液漏斗滴入到圆底烧瓶![]() 。
。
序号 | 烧瓶中的物质 | 实验记录 | 实验结论 |
实验一 | 足量 |
|
|
实验二 |
|
|
|
![]() 在测量气体体积时,除要注意待气体温度恢复至室温、平视度数外,还需要注意 ______ ;
在测量气体体积时,除要注意待气体温度恢复至室温、平视度数外,还需要注意 ______ ;
![]() 实验一、二中参加反应的
实验一、二中参加反应的![]() 的物质的量之比为 ______ 。
的物质的量之比为 ______ 。
【答案】Zn ![]()
![]() 烧杯和玻璃棒 催化剂 氧化剂 上下移动B管,使A、B两管中液面相平 2:1
烧杯和玻璃棒 催化剂 氧化剂 上下移动B管,使A、B两管中液面相平 2:1
【解析】
![]() 锌锰干电池的负极上Zn失去电子;
锌锰干电池的负极上Zn失去电子; ![]() 离子在正极得电子生成氨气和氢气;根据
离子在正极得电子生成氨气和氢气;根据![]() 计算消耗Zn的质量;
计算消耗Zn的质量;
(2)根据基本操作溶解和过滤操作分析;
(3)实验一涉及反应为![]() ,实验二中的反应为
,实验二中的反应为![]() 。
。
![]() 锌锰干电池的负极上Zn失去电子,负极反应为
锌锰干电池的负极上Zn失去电子,负极反应为![]() ,该电池的负极材料是Zn;由
,该电池的负极材料是Zn;由![]() 离子在正极放电产生2种气体,其中一种气体分子是含
离子在正极放电产生2种气体,其中一种气体分子是含![]() 的微粒为氨气,另一种为氢气,正极反应为
的微粒为氨气,另一种为氢气,正极反应为![]() ,当电路中每通过
,当电路中每通过![]() ,根据负极反应
,根据负极反应![]() ,可知消耗
,可知消耗![]() ,质量为
,质量为![]() ;
;
![]() 溶解需要玻璃棒、烧杯等仪器,过滤需要玻璃棒、烧杯以及漏斗等仪器,则均使用的玻璃仪器为烧杯和玻璃棒;
溶解需要玻璃棒、烧杯等仪器,过滤需要玻璃棒、烧杯以及漏斗等仪器,则均使用的玻璃仪器为烧杯和玻璃棒;
![]() ①充分反应后未见黑色固体物质减少,二氧化锰起到催化剂的作用,过氧化氢在二氧化锰催化作用下生成氧气;
①充分反应后未见黑色固体物质减少,二氧化锰起到催化剂的作用,过氧化氢在二氧化锰催化作用下生成氧气;
②充分反应后黑色粉末部分溶解,生成锰离子,Mn元素化合价降低,反应中二氧化锰起到氧化剂的作用;
③测量气体体积时,除要注意待气体温度恢复至室温、平视读数外,要注意上下移动B管,使A、B两管中液面相平;
④实验一涉及反应为![]() 、实验二中反应生成锰离子、水、氧气,离子反应为
、实验二中反应生成锰离子、水、氧气,离子反应为![]() ,由氧气的体积1:1可知,参加反应的
,由氧气的体积1:1可知,参加反应的![]() 的物质的量之比为2:1。
的物质的量之比为2:1。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】一种气态烷烃和一种气态烯烃的混合物共10g,平均相对分子质量为25。使混合气通过足量溴水,溴水增重8.4g,则混合气中的烃可能是( )
A.乙烷和丙烯B.甲烷和丙烯C.甲烷和乙烯D.乙烷和乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在温度低于570 ℃时,还原铁粉与水蒸气反应的产物是FeO,高于570 ℃时,生成Fe3O4。老师用上图所示实验装置,完成了还原铁粉与水蒸气反应的演示实验。
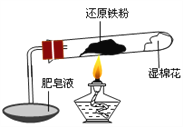
甲同学为探究实验后试管内的固体含有哪些物质,进行了下列实验:
实验编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末放入试管中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
② | 向试管中滴加几滴KSCN溶液,振荡 | 溶液没有出现血红色 |
根据上述实验,下列说法不正确的是
A.试管内的固体一定含有铁粉
B.试管内的固体一定不含有Fe3O4
C.不能确定试管内的固体一定含有FeO
D.可通过将试管内固体彻底还原,分析其质量减小的方法来确定是否含有Fe3O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,3—环己二酮(![]() )常用作医药中间体,用于有机合成。1,3—环己二酮的一种合成路线如图所示。
)常用作医药中间体,用于有机合成。1,3—环己二酮的一种合成路线如图所示。
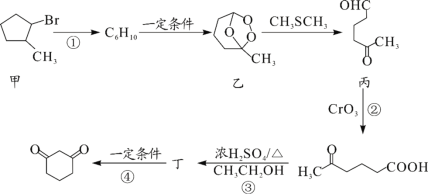
回答下列问题:
(1)甲的分子式为___。
(2)丙中含有官能团的名称是___。
(3)反应①所需的试剂和条件是___;②的反应类型是___。
(4)丁的结构简式为___。
(5)写出丙与新制氢氧化铜悬浊液反应的化学方程式___。
(6)符合下列条件的乙的同分异构体共有___种。
①能发生银镜反应
②能与NaHCO3溶液反应
其中核磁共振氢谱峰面积之比为1∶1∶2∶6的一种同分异构体的结构简式为___(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向![]() 恒容密闭容器中充入
恒容密闭容器中充入![]()
![]() ,反应
,反应![]() 经过一段时间后达到平衡。反应过程中测定的部分数据见表:下列说法正确的是
经过一段时间后达到平衡。反应过程中测定的部分数据见表:下列说法正确的是![]()
| 0 | 50 | 150 | 250 | 350 |
| 0 |
|
|
|
|
A.反应在前50s的平均速率![]()
![]()
B.保持其他条件不变,升高温度,平衡时![]()
![]() ,则反应的
,则反应的![]()
C.相同温度下,起始时向容器中充入![]() mol
mol![]() 、
、![]() mol
mol![]() 和
和![]() mol
mol![]() ,反应达到平衡前
,反应达到平衡前![]() 正
正![]() 逆
逆![]()
D.相同温度下,起始时向容器中充入![]() mol
mol![]() 和
和![]() mol
mol![]() ,达到平衡时,
,达到平衡时,![]() 的转化率小于
的转化率小于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,△H1>△H2的是( )
①C(s)+O2(g)=CO2(g) △H1 C(s)+![]() O2(g)=CO(g) △H2
O2(g)=CO(g) △H2
②S(s)+O2(g)=SO2(g) △H1 S(g)+O2(g)=SO2(g) △H2
③H2(g)+![]() O2(g)=H2O(l) △H1 2H2(g)+O2(g)=2H2O(l) △H2
O2(g)=H2O(l) △H1 2H2(g)+O2(g)=2H2O(l) △H2
④CaCO3(s)=CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)=Ca(OH)2(s) △H2
A.①B.④C.②③④D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①写出漂白粉的有效成分的化学式:________________
②写出甘氨酸的结构简式:_______________
(2)写出苯和浓硝酸在浓H2SO4催化作用下,50~60℃时生成硝基苯的方程式:_______________
(3)相对分子质量为58的烷烃,它可能的结构简式:_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,采用酸性溶液为电解液;则氢气应通入____极 (填a或b)。a极发生电极反应式为:____________
II.某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下( 累计值,体积已换算成标准状态) :

(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大_______ ,原因是______________
(2)哪一时间段的反应速率最小________,原因是_________________________。
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率( 设溶液体积不变)________
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液:
A. 蒸馏水 B. NaCl溶液C. Na2CO3溶液D. CuSO4溶液
可行的是(填编号)________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以链烃A为原料合成两种高分子材料的路线如下图所示:
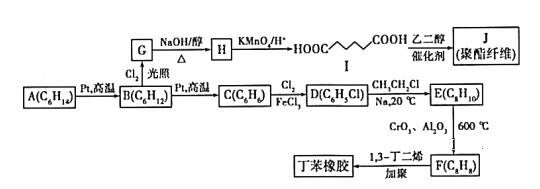
已知以下信息:①分子式A(C6H14)、B(C6H12) 、C(C6H6) 、D(C6H5Cl) 、E(C8H10) 、F(C8H8)
②B(C6H12)的核磁共振氢谱中只有1组峰,G为一氯代烃;
③R1-X+R2-X ![]() R1- R2 (X代表卤素原子,R1、R2代表烃基)。
R1- R2 (X代表卤素原子,R1、R2代表烃基)。
④![]()
![]()
![]() +R3-COOH(R1、R2、R3代表烃基)。
+R3-COOH(R1、R2、R3代表烃基)。
请回答以下问题:
(1) B的化学名称为______________________。
(2)由G生成H的化学方程式为_____________________。
(3)由C生成D的反应类型为_____________。
(4)F的结构简式为_________________。
(5)I的同分异构体中能同时满足下列条件的共有____________种(不含立体异构)。
①能与饱和NaHCO3溶液反应产生气体;②既能发生银镜反应,又能发生水解反应。其中核磁共振氢谱中有4组峰,且峰面积之比为6:2:1:1的是________(写出其中一种的结构简式)。
(6)参照上述合成路线,以2-甲基己烷和一氯甲烷为原料(无机试剂任选),设计制备化合物E的合成路线___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com