
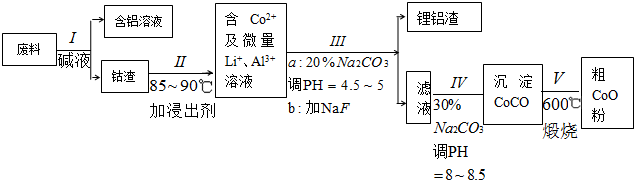
分析 操作Ⅰ利用了铝能溶解在氢氧化钠溶液的性质,将铝从废料中分离出来,过滤后得到含Co2O3•CoO的钴渣,再用酸溶解过滤后得到含Co3+及Al3+、Li+的滤液,通过调整溶液的pH得到Al(OH)3和LiF沉淀,再过滤得到含Co3+的滤液,再滴加Na2CO3溶液得到CoCO3沉淀,经过滤、洗涤沉淀,最后将CoCO3进行加热分解可得CoO粉末,
(1)Al和NaOH溶液发生氧化还原反应生成偏铝酸钠和氢气;
(2)Co2O3•CoO在酸性条件下和硫代硫酸钠反应生成钴离子、硫酸根离子和水;
Co2O3•CoO具有氧化性,HCl具有还原性,二者发生氧化还原反应;
(3)Al3+和CO32-发生双水解反应生成Al(OH)3和CO2;Co2+和CO32-反应生成CoCO3沉淀;
(4)任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
(5)根据关系式CoCl2•6H2O~CoCl2求出CoCl2•6H2O的质量,然后再根据差量法求出B物质的化学式.
解答 解:操作Ⅰ利用了铝能溶解在氢氧化钠溶液的性质,将铝从废料中分离出来,过滤后得到含Co2O3•CoO的钴渣,再用酸溶解过滤后得到含Co3+及Al3+、Li+的滤液,通过调整溶液的pH得到Al(OH)3和LiF沉淀,再过滤得到含Co3+的滤液,再滴加Na2CO3溶液得到CoCO3沉淀,经过滤、洗涤沉淀,最后将CoCO3进行加热分解可得CoO粉末,
(1)Al和NaOH溶液发生氧化还原反应生成偏铝酸钠和氢气,反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(2)Co2O3•CoO在酸性条件下和硫代硫酸钠反应生成钴离子、硫酸根离子和水,离子方程式为4Co2O3•CoO+S2O32-+22H+=12Co2++2SO42-+11H2O;
Co2O3•CoO具有氧化性,HCl具有还原性,二者发生氧化还原反应生成氯气,氯气有毒,污染环境,所以不能用盐酸;
故答案为:4Co2O3•CoO+S2O32-+22H+=12Co2++2SO42-+11H2O;Co2O3•CoO可氧化盐酸产生Cl2,污染环境;
(3)Al3+和CO32-发生双水解反应生成Al(OH)3和CO2;Co2+和CO32-反应生成CoCO3沉淀,离子方程式分别为2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑、Co2++CO32-=CoCO3↓,故答案为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;Co2++CO32-=CoCO3↓;
(4)A.碳酸根离子水解、碳酸氢根离子水解程度大于电离程度导致溶液中碱性,所以c(OH-)>c(H+),碳酸根离子、碳酸氢根离子水解程度都较小,所以溶液中存在c(CO32-)>c(HCO3-)>c(OH-)>c(H+),故A正确;
B.溶液中存在电荷守恒c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),存在物料守恒3c(Na+)=5c(CO32-)+5c(HCO3-)+5c(H2CO3),则3c(OH-)=3c(H+)+2c(HCO3-)+5c(H2CO3)+2c(CO32-),故B错误;
C.根据物料守恒可得:3c(Na+)=5c(CO32-)+5c(HCO3-)+5c(H2CO3),所以3c(Na+)>5c(CO32-)+5c(HCO3-),故C错误;
D.溶液中存在电荷守恒c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故D正确;
故答案为:AD;
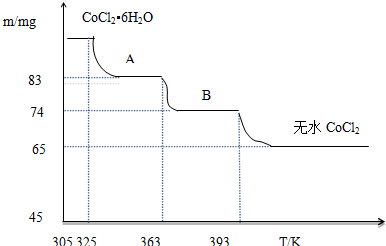
(5)CoCl2•6H2O~CoCl2
238 130
m 65mg
$\frac{238}{m}$,解得:m=119mg
B物质的化学式为CoCl2•nH2O,则有:
CoCl2•6H2O~CoCl2•nH2O△m
238 18(6-n)
119mg 119mg-74mg
$\frac{238}{119mg}$=$\frac{18(6-n)}{(119-74)mg}$,解得:n=1,
所以B物质的化学式为:CoCl2•H2O,
故答案为:CoCl2•H2O.
点评 本题考查物质分离和提纯、离子浓度大小比较、化学方程式的有关计算等知识点,为高频考点,明确物质性质、各物质之间的关系、常见物质分离提纯方法等知识点是解本题关键,知道流程图中发生的反应及基本操作方法,难点是B物质化学式的确定.


科目:高中化学 来源: 题型:选择题
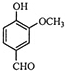
| A. | A的分子式是C8H10O3 | B. | A分子中含有酯基 | ||
| C. | A只能发生取代反应 | D. | A能与Na反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaCl、HCl、NaAlO2、NaHCO3 | B. | NaSO4、KNO3、(NH4)2SO4、MgCl2 | ||
| C. | FeCl3、NaOH、AlCl3、HNO3 | D. | AgNO3、NaCl、NaSO4、NaI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲装置:可用来证明硫的非金属性比硅强 | |
| B. | 乙装置:用盐酸标准液测氢氧化钠溶液浓度 | |
| C. | 丙装置:配制一定物质的量浓度的氢氧化钠溶液 | |
| D. | 丁装置:可在瓶中先装满水,气体由②口入,收集NO气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2Cr2O7的溶液中存在的平衡体系:Cr2O72-+H2O?2CrO42-+2H+ | |
| B. | 硫代硫酸钠与硫酸的离子方程式:S2O32-+2H+═SO2↑+S↓+H2O | |
| C. | KI溶液中滴加稀硫酸、双氧水:2H++2I-+H2O2═I2+2H2O | |
| D. | 用H2S沉淀硫酸铜中铜离子:S2-+Cu2+═CuS↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com