
| A. | 最外层电子数大于4 | B. | 具有负化合价 | ||
| C. | 最高价氧化物对应水化物是酸 | D. | 具有可变化合价 |
分析 A.有些金属元素最外层上的电子数大于4;
B.金属元素在化合物中化合价一定为正价;
C.金属元素也能形成含氧酸;
D.金属元素也可能含有多种价态.
解答 解;A.有些金属元素最外层上的电子数大于4,如Sb最外层上有5个电子,属于金属元素,故A错误;
B.金属元素在化合物中化合价一定为正价,在化合物中元素的化合价为负价的一定是非金属元素,故B正确;
C.金属元素也能形成含氧酸,如高锰酸是金属元素锰的最高价氧化物对应的水化物,故C错误;
D.金属元素也可能含有多种价态,如铁元素有+2和+3两种正化合物,故D错误.
故选B.
点评 本题考查了元素化合物性质,题目难度不大,侧重于基础知识考查,注意把握金属元素与非金属元素的区别.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑦ | B. | ①④⑦ | C. | ①③④⑤⑥ | D. | ②③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯、乙醇和乙酸都能发生取代反应 | |
| B. | 等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量相等 | |
| C. | 乙醇、乙酸和乙酸乙酯能用饱和NaHCO3溶液鉴别 | |
| D. | 乙烷和丙烯的物质的量各1mol,完成燃烧生成3molH2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
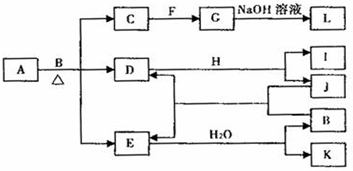
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 喷水冷却燃烧物,冷却灭火 | B. | 沙土覆盖燃烧物,窒息灭火 | ||
| C. | 移开易燃易爆物,隔离灭火 | D. | 喷入化学灭火剂,抑制灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
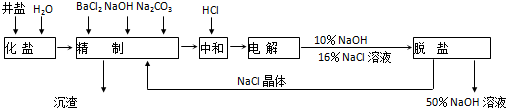
| 温度/℃ | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| NaOH/g | 109 | 118 | 129 | 146 | 177 | 300 | 313 | 318 | 337 |
| NaCl/g | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
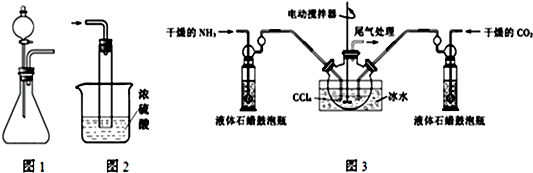
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙苯和环己烯都能使酸性高锰酸钾溶液褪色 | |
| B. | 糖、油脂、蛋白质都能发生水解反应 | |
| C. | 甲醛和乙二醇都可作为合成高分子化合物的单体 | |
| D. | 丙烷和2-甲基丙烷的一氯代物均为两种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com