
分析 4HCl (浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$ 2H2O+Cl2↑+MnCl2中,Mn元素的化合价从+4价降为+2价,Cl元素从-1价升高为0价,反应中转移2个电子,若MnO2与足量的浓盐酸反应制得7.1g Cl2,即n(Cl2)=$\frac{7.1g}{71g/mol}$=0.1mol,则参加反应的HCl为0.1mol×4=0.4mol,生成MnCl2的物质的量为0.1mol,根据方程式分析计算.
解答 解:(1)Mn元素的化合价从+4价降为+2价,Cl元素从-1价升高为0价,反应中转移2个电子,则用双线桥表示为 ,故答案为:
,故答案为: ;
;
(2)n(Cl2)=$\frac{7.1g}{71g/mol}$=0.1mol,则参加反应的HCl为0.1mol×4=0.4mol,其中被氧化的HCl占二分之一,即为0.2mol;
答:反应中被氧化的HCl的物质的量为0.2mol;
(3)假设浓盐酸全部反应完且氯气也不溶于水,最后形成的溶液的体积为200mL,则形成的溶液中溶质MnCl2的物质的量浓度为$\frac{0.1mol}{0.2L}$=0.5mol/L,
答:形成的溶液中溶质的物质的量浓度0.5mol/L.
点评 本题考查用双线桥法分析氧化还原反应、物质的量的有关计算,题目难度不大,侧重于考查学生的分析能力和计算能力.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源:2017届宁夏高三上第二次适应性考试化学卷(解析版) 题型:推断题
某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
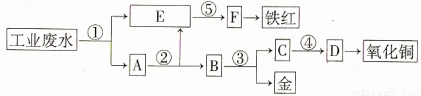
填写下面空白。
(1)图中标号处需加入的相应物质分别是① 、② 、③ 、④ 、⑤ ;
(2)写出①处发生反应的离子方程式 ;写出③处发生反应的化学方程式 ;
(3)铁红的化学式为 ;分别写出铁红和氧化铜在工业上的一种主要用途:铁红 ;氧化铜 。
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上第二次月考化学试卷(解析版) 题型:选择题
捕碳技术是指从空气中捕获CO2的技术。目前NH3已经被用作工业捕碳剂。下列物质中不能作为捕碳剂的是
A.Na2CO3 B.H2NCH2CH2NH2 C.(NH4)2CO3 D.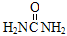
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,这种炔烃的名称为( )
,这种炔烃的名称为( )| A. | 5-甲基-3-乙基-1-己炔 | B. | 5-甲基-3-乙基-2-己炔 | ||
| C. | 4-甲基-5-乙基-2-己炔 | D. | 2-甲基-4-乙基-5-己炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
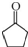
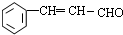 +2Cu(OH)2 $\stackrel{△}{→}$
+2Cu(OH)2 $\stackrel{△}{→}$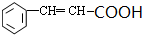 +Cu2O↓+3H2O.
+Cu2O↓+3H2O.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
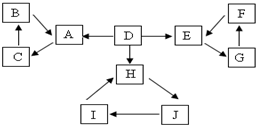 A、B、C、D、E、F、G、H、I、J有如图所示的转化关系.图中所有物质均由短周期元素组成,且每个小三角形内的三种物质均至少含有第三周期中的一种相同元素.其它信息见表:
A、B、C、D、E、F、G、H、I、J有如图所示的转化关系.图中所有物质均由短周期元素组成,且每个小三角形内的三种物质均至少含有第三周期中的一种相同元素.其它信息见表:| 编号 | 信息 | 编号 | 信息 |
| 1 | D为地壳中含量最高的元素组成的单质 | 4 | H为淡黄色固体化合物 |
| 2 | E为酸性气态氧化物 | 5 | 电解饱和J溶液是工业重要反应 |
| 3 | F的浓溶液常做干燥剂 | 6 | C为离子化合物,阴、阳离子均含金属元素 |
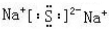 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
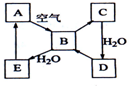 下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.
下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入有色布条,一会儿有色布条褪色,说明溶液中有HC1O存在 | |
| B. | 溶液呈黄绿色,且有刺激性气味,说明有C12分子存在 | |
| C. | 加入硝酸酸化的AgNO3溶液产生白色沉淀,说明有C1-存在 | |
| D. | 加入NaOH溶液,氯水黄绿色消失,说明有HC1O分子存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com