
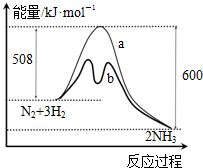
| A. | 升高温度可增大正反应速率,降低逆反应速率 | |
| B. | 正反应的活化能大于逆反应的活化能 | |
| C. | a曲线是未加入催化剂时的能量变化曲线 | |
| D. | 该反应的热化学方程式为:2NH3?N2+3H2△H=-92 kJ•mol-1 |
分析 由图象可知,反应物总能量大于生成物总能量,正反应为放热反应,加入催化剂,降低活化能,b应为加入催化剂,1mol氮气和3mol氢气,反应热为△H=-92 kJ•mol-1,以此解答该题.
解答 解:A.升高温度可同时增大正逆反应速率,故A错误;
B.正反应为放热反应,正反应的活化能小于逆反应的活化能,故B错误;
C.加入催化剂,降低活化能,b应为加入催化剂,a曲线是未加入催化剂,故C正确;
D.1mol氮气和3mol氢气,反应热为△H=-92 kJ•mol-1,则该反应的热化学方程式为:2NH3(g)?N2(g)+3H2(g)△H=+92 kJ•mol-1,故D错误.
故选C.
点评 本题考查化学反应与能量变化,为高频考点,侧重于热化学方程式书写,图象分析判断,反应能量变化,催化剂作用分析,题目难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | M与T形成的化合物熔沸点高 | |
| B. | 最高价氧化物对应的水化物碱性:L<Q | |
| C. | 氢化物的还原性:H2 R<H2 T | |
| D. | 离子半径:T2-<L2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,0.2mol•L-1的一元酸HCl与等浓度的MOH溶液等体积混合后,所得溶液中部分微粒组成及浓度如图所示,下列说法正确的是( )
常温下,0.2mol•L-1的一元酸HCl与等浓度的MOH溶液等体积混合后,所得溶液中部分微粒组成及浓度如图所示,下列说法正确的是( )| A. | MOH为强碱 | |
| B. | 该混合液pH=7 | |
| C. | 该混合溶液中:c(Cl-)=c(M+) | |
| D. | 图中X表示M+,Y表示H+,Y表示MOH,R表示OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+的轨道表示式: | B. | Na+的结构示意图: | ||
| C. | Na的电子排布式:1s22s22p63s1 | D. | Na的简化电子排布式:[Ne]3s1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 高温下超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价.如图所示为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是( )
高温下超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价.如图所示为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是( )| A. | 超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2- | |
| B. | 晶体中每个K+周围有8个O2-,每个O2-周围有8个K+ | |
| C. | 晶体中与每个K+距离最近的K+有8个 | |
| D. | 晶体中,0价氧与-2价氧的数目比为2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com