
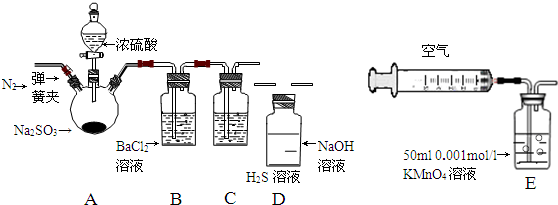
ÓĆÖŠŗĶµĪ¶ØµÄ·½·Ø²ā¶ØNaOHŗĶNa2CO3µÄ»ģŗĻČÜŅŗÖŠNaOHµÄŗ¬ Į棬æÉĻČŌŚ»ģŗĻŅŗÖŠ¼ÓČė¹żĮæµÄBaCl2ČÜŅŗ£¬Ź¹Na2CO3ĶźČ«×Ŗ±ä³ÉBaCO3³Įµķ£¬Č»ŗóÓƱź×¼ŃĪĖįµĪ¶Ø(ŅŃÖŖ¼øÖÖĖį¼īÖøŹ¾¼Į±äÉ«µÄpH·¶Ī§£ŗ¢Ł¼×»ł³Č3.1”«4.4 ¢Ś¼×»łŗģ4.4”«6.2 ¢Ū·ÓĢŖ8.2”«10)”£
Į棬æÉĻČŌŚ»ģŗĻŅŗÖŠ¼ÓČė¹żĮæµÄBaCl2ČÜŅŗ£¬Ź¹Na2CO3ĶźČ«×Ŗ±ä³ÉBaCO3³Įµķ£¬Č»ŗóÓƱź×¼ŃĪĖįµĪ¶Ø(ŅŃÖŖ¼øÖÖĖį¼īÖøŹ¾¼Į±äÉ«µÄpH·¶Ī§£ŗ¢Ł¼×»ł³Č3.1”«4.4 ¢Ś¼×»łŗģ4.4”«6.2 ¢Ū·ÓĢŖ8.2”«10)”£
(1)µĪ¶ØŹ±Ó¦Ń”ÓĆ  ×÷ÖøŹ¾¼Į£»
×÷ÖøŹ¾¼Į£»
(2)ÅŠ¶Ļµ½“ļµĪ¶ØÖÕµćµÄŹµŃéĻÖĻóŹĒ  ”£
ӣ
(3)ĻĀĮŠ²Ł×÷»įµ¼ÖĀÉÕ¼īѳʷ֊NaOHŗ¬Įæ²ā¶ØֵʫøߵďĒ
A£®×¶ŠĪĘæÓĆÕōĮóĖ®Ļ“ŗóĪ“ÓĆ“ż²āŅŗČóĻ“
B£®ĖįŹ½µĪ¶Ø¹ÜÓĆÕōĮóĖ®Ļ“ŗóĪ“ÓƱź×¼ŅŗČóĻ“
C£®ŌŚµĪ ¶ØĒ°ÓŠĘųÅŻ£¬µĪ¶ØŗóĘųÅŻĻūŹ§
¶ØĒ°ÓŠĘųÅŻ£¬µĪ¶ØŗóĘųÅŻĻūŹ§
D£®µĪ¶ØĒ°Ę½ŹÓ¶ĮŹż£¬µĪ¶Ø½įŹųø©ŹÓ¶ĮŹż
(4)ĪŖ²ā¶ØijÉÕ¼īѳʷ֊NaOHµÄŗ¬Įæ(Éčѳʷ֊ŌÓÖŹĪŖNa2CO3)£¬Ä³Ķ¬Ń§½ųŠŠČēĻĀŹµŃé£ŗ×¼Č·³ĘČ”5.0gѳʷÅäÖĘ³É250mLČÜŅŗ£¬Č»ŗó·ÖČż“Īø÷Č”ÅäÖĘŗƵÄÉÕ¼īČÜŅŗ20.00mLÓŚČżøöÓĆÕōĮóĖ®Ļ“¾»µÄ׶ŠĪĘæÖŠ£¬·Ö±š¼Ó Čė¹żĮæµÄBaCl2ČÜŅŗ£¬²¢Ļņ׶ŠĪĘæÖŠø÷¼ÓČė1”«2µĪÖøŹ¾¼Į£¬ÓĆÅضČĪŖ0.2000mol”¤
Čė¹żĮæµÄBaCl2ČÜŅŗ£¬²¢Ļņ׶ŠĪĘæÖŠø÷¼ÓČė1”«2µĪÖøŹ¾¼Į£¬ÓĆÅضČĪŖ0.2000mol”¤ L-1µÄŃĪĖį±ź×¼Ņŗ½ųŠŠµĪ¶Ø£¬Ļą¹ŲŹż¾Ż¼ĒĀ¼ČēĻĀ£ŗ
L-1µÄŃĪĖį±ź×¼Ņŗ½ųŠŠµĪ¶Ø£¬Ļą¹ŲŹż¾Ż¼ĒĀ¼ČēĻĀ£ŗ
ŹµŃ鱹ŗÅ | V(ÉÕ¼īČÜŅŗ)/mL | V(HCl)/mL | |
³õ¶ĮŹż | Ä©¶ĮŹż | ||
1 | 20.00 | 0.80 | 21.00 |
2 | 20.00 | 1.00 | 20.80 |
3 | 20.00 | 0.20 | 22.80 |
ŅĄ¾Ż±ķÖŠŹż¾Ż£¬¼ĘĖć³öÉÕ¼īѳʷ֊ŗ¬NaOHµÄÖŹĮæ·ÖŹżĪŖ ”£(Š”Źżµćŗó±£ĮōĮ½Ī»Źż×Ö)

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ž£¾¢Ż£¾¢Ü£¾¢Ł£¾¢Ū£¾¢Ś | B£® | ¢Ž£¾¢Ü£¾¢Ż£¾¢Ł£¾¢Ū£¾¢Ś | C£® | ¢Ž£¾¢Ü£¾¢Ż£¾¢Ł£¾¢Ś£¾¢Ū | D£® | ¢Ž£¾¢Ż£¾¢Ü£¾¢Ł£¾¢Ū£¾¢Ś |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
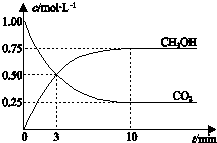
| A£® | ÉżøßĪĀ¶ČÄÜŹ¹$\frac{c£ØC{H}_{3}OH£©}{c£ØC{O}_{2}£©}$ Ōö“ó | |
| B£® | ·“Ó¦“ļµ½Ę½ŗāדĢ¬Ź±£¬CO2µÄĘ½ŗā×Ŗ»ÆĀŹĪŖ75% | |
| C£® | 3 minŹ±£¬ÓĆCO2µÄÅØ¶Č±ķŹ¾µÄÕż·“Ó¦ĖŁĀŹµČÓŚÓĆCH3OHµÄÅØ¶Č±ķŹ¾µÄÄę·“Ó¦ĖŁĀŹ | |
| D£® | “Ó·“Ó¦æŖŹ¼µ½Ę½ŗā£¬H2µÄĘ½¾ł·“Ó¦ĖŁĀŹ¦Ō£ØH2£©=0.075 mol•L-1•min-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ŹµŃé²½Öč | ŹµŃé²Ł×÷ | Ō¤ĘŚĻÖĻóÓė½įĀŪ |
| 1 | ȔɣĮæČÜŅŗÓŚŹŌ¹Ü£¬µĪČė¼øµĪ·ÓĢŖ | ČÜŅŗ±äŗģ |
| 2 | Č»ŗó¼ÓČė×ćĮæµÄBaCl2ČÜŅŗ | ČÜŅŗÖŠ²śÉś°×É«³Įµķ£¬×īŗóČōŗģÉ«ĶŹČ„£¬ŌņĖµĆ÷¢ŁÕżČ·£»ČōŗģÉ«²»ÄÜĶŹČ„£¬ŌņĖµĆ÷¢ŚÕżČ· |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017ѧğ½Ī÷Ź”ø߶žÉĻ10ŌĀŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ŅŃÖŖĻĀĮŠĮ½øöĘųĢ¬ĪļÖŹÖ®¼äµÄ·“Ó¦£ŗ
C2H2(g)+H2(g)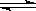 C2H4(g)¢Ł
C2H4(g)¢Ł
2CH4(g)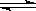 C2H4(g)+2H2(g)¢Ś
C2H4(g)+2H2(g)¢Ś
ŅŃÖŖŌŚ½µµĶĪĀ¶ČŹ±¢ŁŹ½Ę½ŗāĻņÓŅŅĘ¶Æ£¬¢ŚŹ½Ę½ŗāĻņ×óŅĘ¶Æ£¬ŌņĻĀĮŠČżøö·“Ó¦£ŗ
(Q1”¢Q2”¢Q3¾łĪŖÕżÖµ)
C(s)+2H2(g)=CH4(g)¦¤H=£Q1
2C(s)+H2(g)=C2H2(g)¦¤H=£Q2
2C(s)+2H2(g)=C2H4(g)¦¤H=£Q3QÖµ“óŠ”±Č½ĻÕżČ·µÄŹĒ( )
A. Q1£¾Q3£¾Q2 B. Q1£¾Q2£¾Q3 C. Q2£¾Q1£¾Q3 D. Q3£¾Q1£¾Q2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017ѧğ½Ī÷Ź”ø߶žÉĻ10ŌĀŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ŅŃÖŖijæÉÄę·“Ó¦m A(g)+n B(g) 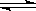 p C(g) ”÷H£¬ŌŚĆܱÕČŻĘ÷ÖŠ½ųŠŠ£¬ČēĶ¼±ķŹ¾ŌŚ²»Ķ¬·“Ó¦Ź±¼ät Ź±ĪĀ¶ČTŗĶŃ¹ĒæPÓė·“Ó¦ĪļBŌŚ»ģŗĻĘųĢåÖŠµÄ°Ł·Öŗ¬ĮæB%µÄ¹ŲĻµĒśĻߣ®ÓÉĒśĻß·ÖĪö£¬ĻĀĮŠÅŠ¶ĻÕżČ·µÄŹĒ( )
p C(g) ”÷H£¬ŌŚĆܱÕČŻĘ÷ÖŠ½ųŠŠ£¬ČēĶ¼±ķŹ¾ŌŚ²»Ķ¬·“Ó¦Ź±¼ät Ź±ĪĀ¶ČTŗĶŃ¹ĒæPÓė·“Ó¦ĪļBŌŚ»ģŗĻĘųĢåÖŠµÄ°Ł·Öŗ¬ĮæB%µÄ¹ŲĻµĒśĻߣ®ÓÉĒśĻß·ÖĪö£¬ĻĀĮŠÅŠ¶ĻÕżČ·µÄŹĒ( )
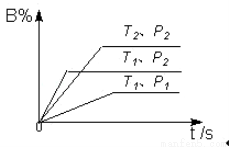
A£®T 1£¼T2£¬P1£¾P2£¬m+n£¾p£¬”÷H£¼0
1£¼T2£¬P1£¾P2£¬m+n£¾p£¬”÷H£¼0
B£®T1£¾T2£¬P1£¼P2£¬m+n£¾p£¬”÷H£¾0
C£®T1£¼T2£¬P1£¾P2£¬m+n£¼p£¬”÷H£¼0
D£®T1£¾T2£¬P1£¼P2£¬m+n£¼p£¬”÷H£¾0
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017ѧğ½Ī÷Ź”ø߶žÉĻŌĀæ¼Ņ»»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ŅŃÖŖij»Æѧ·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½ĪŖK=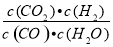 £¬ŌŚ²»Ķ¬µÄĪĀ¶ČĻĀøĆ·“Ó¦µÄĘ½ŗā³£ŹżČē±ķĖłŹ¾£ŗ
£¬ŌŚ²»Ķ¬µÄĪĀ¶ČĻĀøĆ·“Ó¦µÄĘ½ŗā³£ŹżČē±ķĖłŹ¾£ŗ
t/”ę | 700 | 800 | 830 | 1 000 | 1 200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
ĻĀĮŠÓŠ¹ŲŠšŹö²»ÕżČ·µÄŹĒ£Ø £©
A£®øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒCO£Øg£©+H2O£Øg£© CO2£Øg£©+H2£Øg£©
CO2£Øg£©+H2£Øg£©
B£®ÉĻŹö·“Ó¦µÄÕż·“Ó¦ŹĒ·ÅČČ·“Ó¦
C£®ČōŌŚ1LµÄĆܱÕČŻĘ÷ÖŠĶØČėCO2ŗĶH2ø÷1mol£¬5minŗóĪĀ¶ČÉżøßµ½830”ę£¬“ĖŹ±²āµĆCO2ĪŖ0.4molŹ±£¬øĆ·“Ó¦“ļµ½Ę½ŗāדĢ¬
D£®ČōĘ½ŗāÅØ¶Č·ūŗĻĻĀĮŠ¹ŲĻµŹ½£ŗ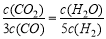 £¬Ōņ“ĖŹ±µÄĪĀ¶ČĪŖ1000”ę
£¬Ōņ“ĖŹ±µÄĪĀ¶ČĪŖ1000”ę
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com