
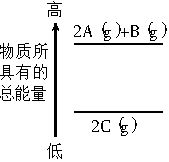
分析如右图所示的能量变化示意图,下列热化学方程式正确的是 ( )。
A.2A(g)+B(g)=2C(g)
ΔH=a(a>0)
B.2A(g)+B(g)=2C(g) ΔH=a(a<0)
C.2A+B=2C ΔH=a(a<0)
D.2C=2A+B ΔH=a(a>0)
科目:高中化学 来源: 题型:阅读理解
 AgOH+H+
AgOH+H+ AgOH+H+
AgOH+H+
| ||
| ||

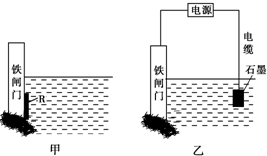 门上的固体材料R可以采用
门上的固体材料R可以采用 方向为
方向为查看答案和解析>>
科目:高中化学 来源:2012-2013学年天津市高三毕业班联考(一)理综化学试卷(解析版) 题型:填空题
氮是地球上含量丰富的一种元素,氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
Ⅰ.(1)N2H4中的N原子最外层达到8电子稳定结构,写出N2H4的结构式_____________。
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 。
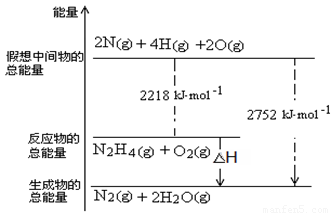
(3)肼是一种高能燃料,有关化学反应的能量变化如右图所示,写出肼燃烧的热化学方程式 。
Ⅱ.氨的合成是最重要的化工生产之一。已知:
N2(g)+3H2(g) 2NH3(g)ΔH=-92.4 kJ·mol-1
2NH3(g)ΔH=-92.4 kJ·mol-1
在3个体积均为2L的密闭容器中,在相同的温度下,使用相同的催化剂合成氨,实验测得反应在起始、达到平衡时的有关数据如下表所示:

试回答:
(1)下列各项能说明该反应已达到平衡状态的是______________(填写序号字母)。
a.容器内N2、H2、NH3的浓度之比为1︰3︰2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)分析上表数据,下列关系正确的是_________(填写序号字母)。
A.2c1>1.5mol·L-1 B.w3=w1 C.2ρ1=ρ2 D.K甲= K乙= K丙
(3)容器乙中反应从开始到达平衡平均速率为v(H2)= _____________。
III.直接供氨式碱性燃料电池的电池反应式是4NH3+3O2=2N2+6H2O,电解质溶液一般使用KOH溶液,则负极电极反应式是__________ 。
查看答案和解析>>
科目:高中化学 来源:2014届四川省绵阳市高二12月月考化学试卷(解析版) 题型:填空题
硫-碘循环分解水制氢主要涉及下列反应:
Ⅰ.SO2+2H2O+I2=H2SO4+2HI Ⅱ. 2HI H2+I2(g)
H2+I2(g)
Ⅲ. 2H2SO4=2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是 。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如右图所示。那么,0~2 min内的平均反应速率:υ(HI)= 。

相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
a.压强 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)用足量Zn和一定量的硫酸制取H2,反应时溶液中水的电离
(H2O H++OH-)平衡 移动(填“向左”“向右”或者“不”);若要减小产生H2的速率而又不影响产生H2的总量,应向硫酸中加入下列试剂中的
。
H++OH-)平衡 移动(填“向左”“向右”或者“不”);若要减小产生H2的速率而又不影响产生H2的总量,应向硫酸中加入下列试剂中的
。
a.Na2CO3溶液 b.K2SO4溶液 c.NaNO3溶液 d.水 e.CuSO4溶液
(4)以H2为燃料制成燃料电池,若:2H2(g)+O2(g)=2H2O(l) ΔH=-572 kJ/mol,
当电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在101 kPa时,CO在1.0 mol O2中完全燃烧,生成2.0 mol CO2,放出566.0 kJ的热量, 则此反应的热化学方程: ;
又已知:2H2(g)+O2(g)=2H2O(g);ΔH=-483.6 kJ/mol,请写出CO2与H2反应生成CO和水蒸气的热化学方程: 。
(2) 拆开1molH-H键、1molN-H键、1molN≡N键分别需要能量是436KJ、391KJ、946KJ,若有1mol N2与H2恰好完全反应生成NH3,则反应的ΔH= 。
(3) 某温度时,在2 L容器中X、Y、Z三种物质的量随 时间的变化曲线如右图所示。由图中数据分析,该反应的化学方程式为: 。
(4) 一定温度下的密闭容器中存在如下反应:
2SO2(g)+O2(g) ![]() 2SO3(g),已知c始(SO2)=0.4mol·L-1,c始(O2)=1mol·L-1,经测定该反应在该温度下的平衡常数K=19,试判断:
2SO3(g),已知c始(SO2)=0.4mol·L-1,c始(O2)=1mol·L-1,经测定该反应在该温度下的平衡常数K=19,试判断:
当SO2转化率为50%时,该反应 (填“是”或“否”)达到平衡状态,若未达到,则向 (填“正”或“逆”, 若已达到平衡此空可不填)方向进行。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com