
一定温度下,容积为2 L的甲、乙两固定容积的密闭容器中,发生反应:2SO2(g)+O2(g)  2SO3(g)。达平衡时测得有关数据如下表。
2SO3(g)。达平衡时测得有关数据如下表。
容器 | 甲 | 乙 |
反应物投入量 | 2 mol SO2、1 mol O2 | 4 mol SO3 |
n(SO3)/mol | 1.6 | a |
反应物的转化率 | α1 | α2 |
下列说法正确的是( )。
A.α1+α2>1
B.1.6<a<3.2
C.若甲中反应2 min时达到平衡,则2 min 内平均速率v(O2)=0.2 mol·L-1·min-1
D.甲平衡后再加入0.2 mol SO2、0.2 mol O2和0.4 mol SO3,平衡正向移动
CD
【解析】乙容器中投入4 mol SO3,相当于投入4 mol SO2、2 mol O2,刚好是甲容器投入量的两倍,可以看成是在两个甲容器中分别投入2 mol SO2、1 mol O2,平衡时分别与甲相同。此时,甲中生成的SO3的物质的量正好等于每份容器中剩余的SO3,所以α1+α3=1。然后加压将两份容器压缩成1个甲容器大小,若平衡不移动,各物质的物质的量均不变, n(SO3)= 1.6 mol×2=3.2 mol。由于该反应是气体化学计量数减小的反应,加压平衡正向移动得到更多SO3,所以乙容器中n(SO3)> 3.2 mol,而且α2<α3,即α1+α2<1,A、B错误。
一定温度下,甲容器中:
2SO2(g) + O2(g)  2SO3(g)
2SO3(g)
初始浓度
(mol·L-1) 1 0.5 0
变化浓度
(mol·L-1) 0.8 0.4 0.8
平衡浓度
(mol·L-1) 0.2 0.1 0.8
v(O2)= 0.4 mol·L-1 ÷ 2 min = 0.2 mol·L-1·min-1,C项正确。
平衡常数为:K= =
=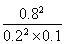 =160。
=160。
D项浓度商为:Qc= =
= =
= <160,所以平衡正向移动,正确。
<160,所以平衡正向移动,正确。


 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案科目:高中化学 来源:2014学年高一化学人教版必修2 1.2.1电子的排布元素周期律练习卷(解析版) 题型:选择题
某粒子结构示意图为 ,若该粒子为离子,则它所带的电荷数可能为( )。
,若该粒子为离子,则它所带的电荷数可能为( )。
①8-n ②n-8 ③10-n ④n-10
A.①②B.①③ C.③④ D.②④
查看答案和解析>>
科目:高中化学 来源:2014学年高一化学人教版必修2 1.1.1元素周期表练习卷(解析版) 题型:选择题
关于元素周期表的说法正确的是( )。
A.元素周期表有8个主族
B.ⅠA族的元素都是金属元素
C.元素周期表有7个周期
D.短周期是指第一、二周期
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮提分训练 专题1物质组成性质分类及化学用语练习卷(解析版) 题型:填空题
化工生产中常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质的分类角度看,不恰当的一种物质是________(填物质名称)。
(2)“三酸”与“两碱”之间的反应,若用化学方程式表示有六个(酸过量时) ,若用离子方程式表示却只有两个,请写出这两个离子方程式:(酸过量时)_____________________________、______________________。
(3)“三酸”常用于溶解金属和金属氧化物。下列块状金属在常温时能全部溶于足量浓硝酸的是________。
A.Au B.Cu
C.Al D.Fe
(4)烧碱、纯碱溶液均可吸收CO2,当含0.1 mol NaOH的溶液吸收一定量CO2后,将溶液低温小心蒸干得到固体的组成可能有四种情况,分别是(填化学式):
①________,②Na2CO3,③________,④NaHCO3。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练2练习卷(解析版) 题型:填空题
甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=206.0 kJ·mol-1
Ⅱ:CO(g)+2H2(g)=CH3OH(g) ΔH=-129.0 kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为______________________________________________________。
(2)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100 L的反应室,在一定条件下发生反应Ⅰ,测得在一定的压强下CH4的转化率与温度的关系如右图。

①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为________。
②100 ℃时反应Ⅰ的平衡常数为________。
(3)在压强为0.1 MPa、温度为300 ℃条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,平衡后将容器的容积压缩到原来的 ,其他条件不变,对平衡体系产生的影响是________(填字母序号)。
,其他条件不变,对平衡体系产生的影响是________(填字母序号)。
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.重新平衡c(H2)/c(CH3OH)减小
E.平衡常数K增大
(4)写出甲醇-空气-KOH溶液的燃料电池负极的电极反应式:__________________________________________________。

(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置模拟上述过程:
①写出阳极电极反应式____________________________。
②写出除去甲醇的离子方程式__________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练2练习卷(解析版) 题型:选择题
V、W、X、Y均是元素周期表中短周期元素,在周期表中的相对位置关系如表所示:
| Y | V |
|
|
X |
|
|
| W |
Z为第四周期常见元素,该元素是人体血液中血红蛋白最重要的组成金属元素。V的最简单氢化物为甲,W的最简单氢化物为乙,甲、乙混合时有白烟生成。下列说法正确的是( )。
A.原子半径:X>Y>V>W
B.X、W的质子数之和与最外层电子数之和的比值为2∶1
C.甲、乙混合时所生成的白烟为离子化合物,但其中含有共价键
D.少量Z的单质与过量W的单质可化合生成ZW2
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练2练习卷(解析版) 题型:选择题
下列各组离子中,在给定条件下能大量共存的是( )。
A.在pH=1的溶液中,NH4+,K+,ClO-,Cl-
B.有SO42-存在的溶液中:Na+,Mg2+,Ba2+,I-
C.有NO3-存在的强酸性溶液中:NH4+,Ba2+,Fe2+,Br-
D.在c(H+)=1.0×10-13 mol·L-1的溶液中:Na+,S2-,AlO2-,SO32-
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练1练习卷(解析版) 题型:选择题
下列离子方程式书写不正确的是( )。
A.NaOH溶液与SO2反应,当n(NaOH)∶n(SO2)=4∶3时,4OH-+3SO2=SO32-+2HSO3-+H2O
B.CuCl2溶液与Na2S溶液2∶1反应:Cu2++S2-=CuS↓
C.Cl2与FeBr2溶液反应,当n(Cl2)∶n(FeBr2)=1∶1时:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
D.1 mol·L-1的NaAlO2溶液和2.5 mol·L-1的盐酸等体积互相均匀混合:2AlO2-+5H+=Al(OH)3↓+Al3++H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第7讲水溶液中的离子平衡练习卷(解析版) 题型:选择题
下列有关电解质溶液的说法正确的是( )。
A.在蒸馏水中滴加浓H2SO4,KW不变
B.CaCO3难溶于稀硫酸,也难溶于醋酸
C.在Na2S稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-)
D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com