
| A. | 海水淡化的主要方法有蒸馏法、电渗析法、离子交换法、反渗透法等 | |
| B. | 海水中的无机盐主要以Na+、Mg2+、K+、Ca2+、SO42-、Cl-、Br-等形式存在 | |
| C. | 海生植物如海带中存在较高浓度的I2,具有很高的开发利用价值 | |
| D. | 从海水中可以提取核反应材料 |
分析 A.根据海水淡化的主要方法分析;
B.根据天然海水中的成分分析,海水中的无机盐主要以Na+、Mg2+、K+、Ca2+、SO42-、Cl-、Br-等形式存在;
C.海洋植物如海带、海藻中含有丰富分碘元素,碘元素以离子的形式存在;
D.铀为核能原料,可从海水中可以提取.
解答 解:A.海水淡化的主要方法有:蒸馏法、电渗析法、离子交换法等,故A正确;
B.天然海水主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子,主要以Na+、Mg2+、K+、Ca2+、SO42-、Cl-、Br-等形式存在,故B正确;
C.海生植物如海带中存在较高浓度的碘元素,具有很高的开发利用价值,但不是含有I2,故C错误;
D.从海水中提取铀和重水等核能开发的重要原料,故D正确;
故选C.
点评 本题考查了海水的综合利用,涉及海水的淡化、海水中的无机盐的主要成分、海水碘的存在形式等,掌握海水的成分及相关工艺为解答关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
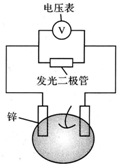 留心处处皆学问.从生活出发进行科学探究,可以获得自信,形成正确的思维方式.甲、乙两位同学一起合作设计完成了水果电池的实验(如图),测得数据如下
留心处处皆学问.从生活出发进行科学探究,可以获得自信,形成正确的思维方式.甲、乙两位同学一起合作设计完成了水果电池的实验(如图),测得数据如下| 实验序号 | 电极材料 | 水果种类 | 电极间距离/cm | 电压/mV |
| 1 | 锌铜 | 菠萝 | 3 | 900 |
| 2 | 锌铜 | 苹果 | 3 | 650 |
| 3 | 锌铜 | 柑橘 | 3 | 850 |
| 4 | 锌铜 | 西红柿 | 3 | 750 |
| 5 | 锌铝 | 菠萝 | 3 | 650 |
| 6 | 锌铝 | 苹果 | 3 | 450 |
| 甲同学 | 乙同学 | |
| A | 实验6中负极电极反应式如何写? | Al-3e-=Al3+ |
| B | 实验1,5中电流方向为什么相反? | 1中锌为负极,电流由铜经导线流向锌,5中铝为负极,铝失去电子,电流由锌经导线流向铝 |
| C | 水果电池的电压与哪些因素有关? | 只跟水果的类型有关 |
| D | 实验中发光二极管不亮,如何使它亮起来 | 可用铜锌作电极,用菠萝作介质,并将多个此电池串联起来 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
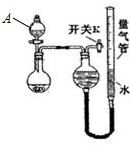 镁、铝、锌是生活中常见的三种金属,查阅资料获得如下信息:
镁、铝、锌是生活中常见的三种金属,查阅资料获得如下信息:| 编号 | 粉末质量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 2.0 g | 10.0 mL | 346.2 mL |
| ② | 2.0 g | 10.0 mL | 335.0 mL |
| ③ | 2.0 g | 10.0 mL | 345.8 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>C>D | B. | A>C>D>B | C. | C>A>B>D | D. | B>D>C>A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeO•3Fe2O3 | B. | 2FeO•3Fe2O3 | C. | FeO•2Fe2O3 | D. | 2FeO•Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na | B. | Mg | C. | Al | D. | Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com