
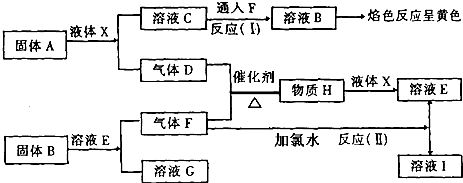
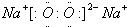
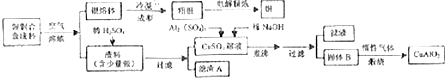
分析 气体F与氯水反应得到E与溶液I,故F具有还原性,可推知F为SO2,气体D与气体F在催化剂加热条件下反应生成H,H与液体X反应得溶液E,可判断D为O2,x为H2O,H为SO3,E为H2SO4,则I为HCl,溶液B焰色反应为黄色,含有Na元素,与液体x反应得到溶液C与气体D,溶液C与F得到溶液B,则A为Na2O2,C为NaOH,B为NaHSO3或Na2SO3,固体B与E溶液反应得到溶液G与气体F,则G为Na2SO4,符合题中各物质转化关系,据此解答.
解答 解:气体F与氯水反应得到E与溶液I,故F具有还原性,可推知F为SO2,气体D与气体F在催化剂加热条件下反应生成H,H与液体X反应得溶液E,可判断D为O2,x为H2O,H为SO3,E为H2SO4,则I为HCl,溶液B焰色反应为黄色,含有Na元素,与液体x反应得到溶液C与气体D,溶液C与F得到溶液B,则A为Na2O2,C为NaOH,B为NaHSO3或Na2SO3,固体B与E溶液反应得到溶液G与气体F,则G为Na2SO4,符合题中各物质转化关系,
(1)根据上面的分析可和,B为NaHSO3或Na2SO3,
故答案为:NaHSO3或Na2SO3;
(2)A为Na2O2,A的电子式是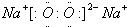 ,
,
故答案为: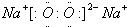 ;
;
(3)D为O2,F为SO2,D和F反应的化学方程式为2SO2+O2$?_{△}^{催化剂}$2SO3,
故答案为:2SO2+O2$?_{△}^{催化剂}$2SO3;
(4)反应II的离子方程式为SO2+Cl2+2H2O=H2SO4+2HCl,
故答案为:SO2+Cl2+2H2O=H2SO4+2HCl.
点评 本题考查无机物推断,涉及Na、S、卤素单质化合物性质,焰色反应及物质的状态为推断突破口,再结合转化关系推断,需要学生熟练掌握元素化合物知识,难度中等.


科目:高中化学 来源: 题型:解答题
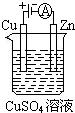 (1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在查看答案和解析>>
科目:高中化学 来源: 题型:解答题
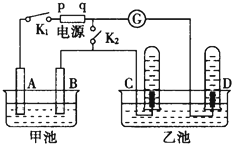 在如图均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,立即停止电解,取出A电极,洗涤、干燥、称量,电极质量增重1.6g.请回答下列问题:
在如图均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,立即停止电解,取出A电极,洗涤、干燥、称量,电极质量增重1.6g.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a-c=m-n | B. | b+d=m+n | C. | a>b>d>c | D. | a>b>c>d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
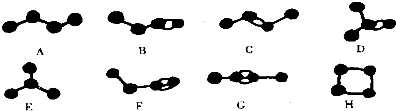
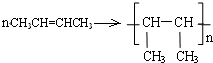 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH=CH2 | B. | CH2=CH-CH=CH2 | C. | C6H5-C≡CH | D. | CH3CH=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4、C3H6 | B. | C2H4、C4H8 | C. | C3H4、C4H8 | D. | C3H4、C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、B、C、D | B. | B、A、C、D | C. | D、A、B、C | D. | B、A、D、C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com