
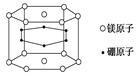
| A.22% | B.70% | C.66.7% | D.33.3% |
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源:不详 题型:填空题
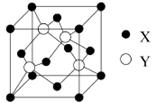
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
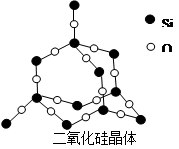
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
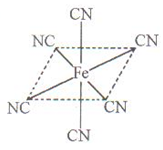
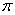 键数目为 。
键数目为 。查看答案和解析>>
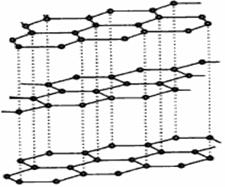
科目:高中化学 来源:不详 题型:填空题
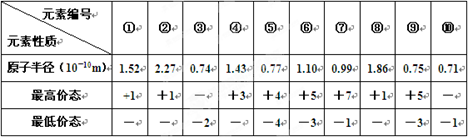
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.甲认为上述发现绝对不可能,因为H3分子违背了共价键理论 |
| B.乙认为宇宙中还可能存在另一种氢单质,因为氢元素有三种同位素必然有三种同素异形体 |
| C.丁认为如果上述的发现存在,则证明传统的价键理论有一定的局限性有待继续发展 |
| D.丙认为H3分子实质上是H2分子与H+以特殊共价键结合的产物,应写成H3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
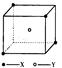
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
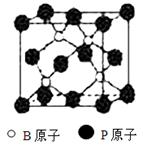
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com