
| A、非金属性:X<Z |
| B、原子半径:X<W<Z<Y |
| C、最高价氧化物对应水化物的酸性:W<Z |
| D、单质Y常温下能溶于浓硝酸 |


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
| 实验操作 | 现象和结论 |
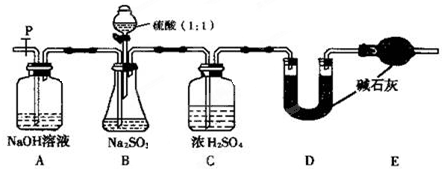
| 步骤1:取少许样品于试管中,加入适量蒸馏水充分溶解,再滴加H2SO4酸化的KMnO4溶液; | 现象:若KMnO4溶液的紫红色褪为无色 ①结论:样品中有 ②褪色的离子方程式为: |
| 步骤2:另取少许样品于试管中,加入适量蒸馏水充分溶解,再滴加稀HCl,使溶液呈酸性,再滴加适量BaCl2溶液; | ③现象:若 结论:假设2成立. |
| … | … |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容器内气体压强不再变化 |
| B、混合气体的密度恒定不变 |
| C、混合气体的颜色不再变化 |
| D、v正(H2)=v逆(HI) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3CH2OH、SO3和水分别属于非电解质、强电解质和弱电解质 |
| B、为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化 |
| C、煤油可由石油分馏获得,可用于保存少量金属钠 |
| D、工业上金属Mg、Al都是用电解其相应的氯化物水溶液制得的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
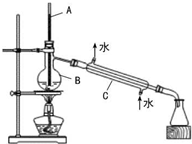 现有一瓶乙二醇和丙三醇的混合物,它们有如下性质,使用右图装置进行分离,下列说法正确的是( )
现有一瓶乙二醇和丙三醇的混合物,它们有如下性质,使用右图装置进行分离,下列说法正确的是( )| 物质 | 沸点/℃ | 溶解性 |
| 乙二醇 | 198 | 易溶于水和乙醇 |
| 丙三醇 | 290 | 能跟水、乙醇任意比互溶 |
| A、在正确操作情况下,锥形瓶中收集到的物质为乙二醇 |
| B、仪器C中进出水口方向错误 |
| C、仪器A为玻璃棒,所处位置错误 |
| D、仪器B的名称为圆底烧瓶. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com