
| A. | 3Fe+4H2O(g) $\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 | B. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | ||
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | 2F2+2H2O═4HF+O2 |
分析 有元素化合价变化的反应为氧化还原反应,水中只有O元素的化合价升高时水只作为还原剂,以此来解答.
解答 解:A.3Fe+4H2O(g) $\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2中,属于氧化还原反应,水中H元素的化合价降低,水作氧化剂,故A错误;
B.2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,水中H、O元素的化合价都发生变化,则水既是氧化剂又是还原剂,故B错误;
C.2Na2O2+2H2O═4NaOH+O2↑中,Na2O2中O元素的化合价既升高又降低,属于氧化还原反应,水中H、O元素的化合价都没有变化时水既不做氧化剂又不做还原剂,故C错误;
D.2F2+2H2O═4HF+O2,该反应中水中只有O元素的化合价升高时水只作为还原剂,故D正确;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化及氧化还原反应基本概念为解答的关键,侧重氧化剂、还原剂判断的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
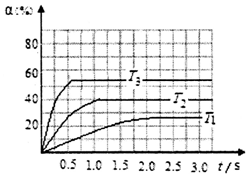 硫及其化合物是重要的化工原料,在工农业生产应用广泛.
硫及其化合物是重要的化工原料,在工农业生产应用广泛.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
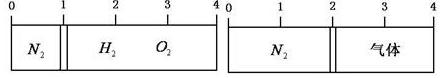
| A. | 3:4 | B. | 4:5 | C. | 6:2 | D. | 2:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯中加溴水振荡,溴水层褪色 | |
| B. | 乙烯通入溴水,溴水褪色 | |
| C. | 石油裂解后的气体通入溴水,溴水褪色 | |
| D. | 苯转化为环己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 伴有能量变化的物质变化都是化学变化 | |
| B. | 催化剂可以改变化学反应速率但不能改变化学反应的反应热 | |
| C. | 室温下,100mLpH=3的HA和HB分别与足量的锌反应,HB放出的氢气多,说明HA酸性比HB弱 | |
| D. | 对于反应2SO2(g)+O2(g)?2SO3(g)△H<0,压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为防止流感传染,可将教室门窗关闭后,用食醋熏蒸,进行消毒 | |
| B. | 医疗上常用高温煮蒸的方法对医疗器械进行消毒 | |
| C. | 生活中常用在豆浆中加入少量石膏的方法来使豆浆凝固制作豆腐 | |
| D. | 对环境进行消毒的原理是使细菌变性,可以用浓HNO3代替“84”消毒液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
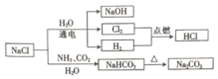
| A. | NaHCO3的热稳定性较好 | |
| B. | H2与Cl2反应时产生苍白色火焰 | |
| C. | NaOH俗称纯碱 | |
| D. | 图中所示转化反应都是氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com