
| A. | 没有阳光 | B. | 温度太低 | C. | 压强太大 | D. | 缺少CO2和O2 |
科目:高中化学 来源: 题型:实验题
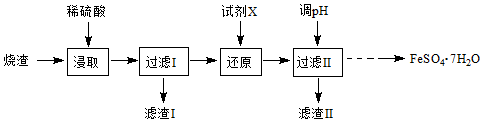
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>X | |
| C. | 最简单氢化物的稳定性:W<Z<X | |
| D. | Y的氧化物不属于两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 废旧电池必须回收,主要目的是回收其中的金属 | |
| B. | “从沙滩到用户”,计算机芯片的材料是指单质硅 | |
| C. | 利用风能,太阳能等清洁能源代替化石燃料,可减少环境污染 | |
| D. | “光化学烟雾”,“硝酸型酸雨”的形成都与氮氧化物有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a<b | B. | a>b | C. | a=b | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200mL 2mol/L MgCl2溶液 | B. | 1000mL 2.5mol/L NaCl溶液 | ||
| C. | 250mL 1mol/L AlCl3溶液 | D. | 300mL 5mol/L KCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
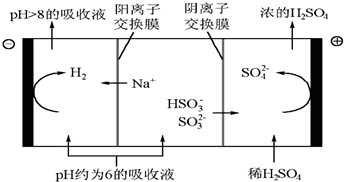
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com