
ijѧ����0.2000mol•L﹣1�ı�NaOH��Һ�ζ�δ֪Ũ�ȵ����ᣬ��������£�
��������ˮϴ�Ӽ�ʽ�ζ��ܣ�������ע��NaOH��Һ����0���̶������ϣ�
�ڹ̶��õζ��ܲ�ʹ�ζ��ܼ������Һ�壻
�۵���Һ������0����0���̶������£������¶�����
����ȡ20.00mL����Һע��ྻ�Ļ�������������ˮ����ƿ�У�������3�η�̪��Һ��
���ñ�Һ�ζ����յ㣬���µζ���Һ�������
��ش�
��1�����ϲ����д�����ǣ����ţ� �����ⶨ���ƫ�ߣ���ԭ������� ��
A�����Ʊ���Һ�Ĺ���NaOH�л���KOH����
B���ζ��յ����ʱ�����ӵζ��ܵĿ̶ȣ�����������ȷ
C��ʢװδ֪Һ����ƿ������ˮϴ��������δ֪Һ��ϴ
D���ζ����յ����ʱ�����ֵζ��ܼ��촦����һ����Һ
��2���жϵζ��յ�������ǣ� ��
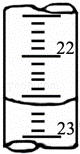
��3����ͼ��ij�εζ�ʱ�ĵζ����е�Һ�棬�����Ϊ ��
��4�������������ݣ���������������Һ��Ũ�ȣ� mol/L��
�ζ����� ���������mL�� ���ռ������mL��
�ζ�ǰ���� �ζ������
��һ�� 20.00 0.40 20.40
�ڶ��� 20.00 2.00 24.10
������ 20.00 4.00 24.00
���㣺 �к͵ζ���
ר�⣺ ʵ���⣮
������ ��1�����ݼ�ʽ�ζ�����װҺǰӦ����װҺ�������ϴ������c�����⣩= ��������������V����������Ӱ�죬�Դ��ж�Ũ�ȵ���
��������������V����������Ӱ�죬�Դ��ж�Ũ�ȵ���
��2��������Һ��ɫ�仯�Ұ�����ڲ���ɫ����˵���ﵽ�ζ��յ㣻
��3�����ݵζ��ܵĽṹ�;�ȷ�ȶ�����
��4���ȸ������ݵ���Ч�ԣ���ȥ��3�����ݣ�Ȼ�����1��2��ƽ������V��NaOH�������Ÿ���c�����⣩= �����㣮
�����㣮
��� �⣺��1�����ݼ�ʽ�ζ�����װҺǰӦ����װҺ�������ϴ��������ˮϴ�Ӽ�ʽ�ζ��ܣ�������ע��NaOH��Һ����0���̶������ϣ�
A�����Ʊ���Һ�Ĺ���NaOH�л���KOH���ʣ����ڵζ�ʱ���ĵ�����ƫ�٣�������������һ��ʱ�����ĵı���Һ�����ƫ����ⶨ���ƫ��A��ȷ��
B���ζ��յ����ʱ�����ӵζ��ܵĿ̶ȣ������Һ�����ƫ����ⶨ���ƫ��B��ȷ��
C��ʢװδ֪Һ����ƿ������ˮϴ��������δ֪Һ��ϴ����ƿ����������ʵ���ƫ�ζ�ʱ���ĵı���Һ�����ƫ�����Բⶨ���ƫ��C��ȷ��
D���ζ����յ����ʱ�����ֵζ��ܼ��촦����һ����Һ�������ĵı���Һ�����ƫ�����Բⶨ���ƫ��D��ȷ��
�ʴ�Ϊ���٣�ABCD��
��2���ζ�ʱ������Һ��ɫ�仯�Ұ�����ڲ���ɫ����˵���ﵽ�ζ��յ㣬���Ե������һ��NaOH��Һʱ����Һ�պ�����ɫ��Ϊ�ۺ죬�Ұ�����ڲ���ɫ��
�ʴ�Ϊ���������һ��NaOH��Һʱ����Һ�պ�����ɫ��Ϊ�ۺ죬�Ұ�����ڲ���ɫ��
��3���ζ����е�Һ�����Ϊ22.60mL��
�ʴ�Ϊ��22.60��
��4�����εζ����ĵ����Ϊ��20.00mL��22.10mL�� 20.00����ȥ��2�����ݣ�Ȼ�����1��2��ƽ������V��NaOH��=20.00mL��
c�����⣩= =
= =0.2000mol•L﹣1��
=0.2000mol•L﹣1��
�ʴ�Ϊ��0.2000��
������ ���⿼��������к͵ζ�����Ŀ�ѶȲ���עע������к͵ζ���ԭ���������������������ķ�����


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������Һ�У�Cl﹣�����ʵ���Ũ����50mL 1mol/L AlCl3��Һ��Cl﹣���ʵ���Ũ������ǣ���
A�� 100mL 1mol/LNaCl��Һ B�� 150mL 3mol/LKCl��Һ
C�� 75mL 1mol/LMgCl2��Һ D�� 25mL 2mol/LAlCl3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��Һ�п����������������е�һ�ֻ��֣�Cl����OH����CO32����SO32����SO42����
��1������Һ���д�����H+����ʱ�������ܴ������ڣ�
����Һ���д�����Ba2+����ʱ�������ܴ�������������
��3������Һ���д�������������ʱ���������������Ӷ������ܴ������ڣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ʽΪC5H12O�Ҳ���������Ʒ�Ӧ�ų��������л��������У������������칹������
A�� 5�� B�� 6�� C�� 7�� D�� 8��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪ij�¶���CH3COOH��NH3•H2O�ĵ��볣����ȣ�����10mLŨ��Ϊ0.1mol•L﹣1��CH3COOH��Һ�еμ���ͬŨ�ȵİ�ˮ���ڵμӹ����У���
A�� ˮ�ĵ���̶�ʼ������
B�� 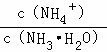 �������ټ�С
�������ټ�С
C�� c��CH3COOH����c��CH3COO﹣��֮��ʼ�ձ��ֲ���
D�� �����백ˮ�����Ϊ10mLʱ��c��NH4+��=c��CH3COO﹣��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ʵ����Ƽ����Ӧ�����ӷ���ʽ����ȷ���ǣ���
A�� ��FeCl3��Һ��ʴͭ��·�壺Cu+2Fe3+=Cu2++2Fe2+
B�� Na2O2��H2O��Ӧ�Ʊ�O2��Na2O2+H2O=2Na++2OH﹣+O2��
C�� ����������ˮ�Ʊ������Cl2+H2O=2H++Cl﹣+ClO﹣
D�� �ö��Ե缫��ⱥ���Ȼ�����Һ��2Cl﹣+2H+ H2��+Cl2��
H2��+Cl2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��������Ϊa%�����ʵ���Ũ��Ϊc mol/L ��KOH��Һ�������ܼ����ָ���ԭ���¶ȣ�������������Ϊ2a%�������ʵ���Ũ�ȱ�Ϊ����
A�� ����2c mol/L B�� ����2c mol/L
C�� С��2c mol/L D�� ��c mol/L��2c mol/L֮��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
FeBr2��һ�ֻ���ɫ��Ƭ״�Ĺ��壬ij�о���ѧϰС��Ϊ��̽�����Ļ�ԭ�ԣ�����������ʵ�飺
I��ʵ����Ҫ90mL 0.1mol/L FeBr2��Һ
��1������FeBr2��Һ���ձ�����Ͳ����ͷ�ι����IJ��������� ��
��2�������й����ƹ�����˵��������� ������ţ���
a���õ�����ƽ��������Ϊ1.944g��FeBr2
b����������FeBr2��������ƿ�У���90nL����ˮ�ܽ�
c��ϴ���ܽ�FeBr2���ձ�������ϴ��Һת��������ƿ��
d������ƿ��ǩ�����õ�FeBr2��Һ
e������ʱ����������ƿ�̶���ʹ���Ƶ�FeBr2��ҺŨ��ƫ��
II��̽��FeBr2�Ļ�ԭ��
ȡ10mL����FeBr2��Һ�������еμ��������Ƶ���ˮ������Һ�ʻ�ɫ��ijͬѧ�Բ�����ɫ��ԭ������˼��裺
����1��Br﹣��C12������Br2�ܽ�����Һ�У� ����2��Fe2+��C12������Fe3+��
��1��������ɱ�����֤���裺
ʵ�鲽�衢Ԥ������ ����
����Һ�м����������Ȼ�̼ ����1��ȷ
������Һ�м��� ����2��ȷ
������1��ȷ����ʵ����з����Br2��ʵ����������� ��
��2��ʵ��֤������ԭ��Fe2+��Br﹣������һ�����ӷ���ʽ��֤���� ��
��3������50mL����FeBr2��Һ��ͨ��5��10﹣3molCl2����Ӧ�����ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����£����и���������ָ����Һ��һ���ܴ���������ǣ���
A�� 0.1 mol��L﹣1 NaOH��Һ��K+��Na+��SO42﹣��CO32﹣
B�� 0.1 mol•L﹣1 Na2CO3��Һ��K+��Ba2+��NO3﹣��Cl﹣
C�� 0.1 mol•L﹣1 FeCl3��Һ��K+��NH4+��I﹣��SCN﹣
D�� 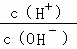 =1��l014����Һ��Ca2+��Na+��ClO﹣��NO3﹣
=1��l014����Һ��Ca2+��Na+��ClO﹣��NO3﹣
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com