
| A. | 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于$\frac{1}{\sqrt{1.8}}$×10-11 mol•L-1 | |
| B. | 向BaCl2溶液中加入AgNO3和KI,当两种沉淀共存时,$\frac{c({I}^{-})}{c(C{l}^{-})}$=5.6×10-7 | |
| C. | AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI | |
| D. | AgCl不溶于水,不能转化为AgI |
分析 A.发生沉淀的转化时,反应为AgCl+I-?AgI+Cl-,则Ksp(AgCl)求出c(Ag+),再利用Ksp(AgI)求出碘离子的浓度;
B.当两种沉淀共存时,银离子浓度相同;
C.沉淀转化时向溶度积更小的方向移动;
D.由Ksp可知,AgI比AgCl更难溶.
解答 解:A.Ksp(AgCl )=1.8×10-10,则c(Ag+)=$\sqrt{1.8×1{0}^{-10}}$,AgCl若要在NaI溶液中开始转化为AgI,则c(I-)=$\frac{Ksp(AgI)}{c(A{g}^{+})}$=$\frac{1.0×1{0}^{-16}}{\sqrt{1.8×1{0}^{-10}}}$=$\frac{1}{\sqrt{1.8}}$×10-11 mol•L-1,即NaI的浓度必须不低于$\frac{1}{\sqrt{1.8}}$×10-11 mol•L-1,故A正确;
B.当两种沉淀共存时,银离子浓度相同,可知$\frac{Ksp(AgCl)}{c(C{l}^{-})}$=$\frac{Ksp(AgI)}{c({I}^{-})}$,则$\frac{c({I}^{-})}{c(C{l}^{-})}$=$\frac{1.0×1{0}^{-16}}{1.8×1{0}^{-10}}$=5.6×10-7,故B正确;
C.沉淀转化时向溶度积更小的方向移动,则AgCl可以转化为AgI,故C正确;
D.由Ksp可知,AgI比AgCl更难溶,AgCl可以转化为AgI,故D错误;
故选D.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握Ksp的计算、沉淀的转化为解答的关键,侧重分析与应用能力的考查,注意Ksp计算为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:解答题
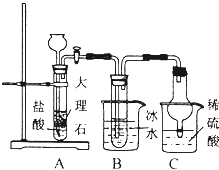 氨气是重要的化工原料.
氨气是重要的化工原料.| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
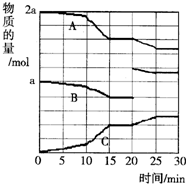
| A. | 10~15 min可能是扩大了容器体积 | B. | 10~15 min可能是降低了温度 | ||
| C. | 20 min时可能是缩小了容器体积 | D. | 20 min时可能是增加了B的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +2 | B. | +3 | C. | +4 | D. | +6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 物质 | 杂质 | 除杂试剂或操作方法 |
| ① | NaCl溶液 | Na2CO3 | 加入盐酸,蒸发 |
| ② | FeSO4溶液 | CuSO4 | 加入过量铁粉并过滤 |
| ③ | H2 | CO2 | 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
| ④ | NaNO3 | CaCO3 | 加稀盐酸溶解、过滤、蒸发、结晶 |
| A. | ①②③④ | B. | ②③④ | C. | ①③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤族元素单质X2(X代表F、Cl、Br、I)均可以与水反应生成HX | |
| B. | 高纯度的硅单质用于制作光导纤维 | |
| C. | 将SO2通入次氯酸钙溶液可得到次氯酸 | |
| D. | 氢氧化铁溶于氢碘酸的离子方程式为:Fe(OH)3+3H+═Fe3++3H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com