
在加入铝粉能产生H2的溶液中,下列各组离子可能大量共存的是( )
A.NH4+ NO3- CO32- Na+
B.Na+ Ba2+ Mg2+ HCO3-
C.NO3- Mg2+ K+ Cl-
D.NO3- K+ [Al(OH)4]- OH-
科目:高中化学 来源: 题型:
在25°C、100 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( )
A.CH3OH(l)+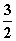 O2(g)===CO2(g)+2H2O(l) ΔH=725.8 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH=725.8 kJ·mol-1
B.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1 452 kJ·mol-1
C.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-725.8 kJ·mol-1
D.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=1 452 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。
电解法:
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(1)用Fe做电极的原因为_____________________________________________。
(2)在阴极附近溶液pH升高的原因是 (用电极反应解释) __________________。
溶液中同时生成的沉淀还有___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在固定密闭容器中,可逆反应2X(g)+2Y(s) 3Z(g),达到平衡后,若将容器中X、Y、Z的物质的量均减少一半,对该反应产生的影响是( )
3Z(g),达到平衡后,若将容器中X、Y、Z的物质的量均减少一半,对该反应产生的影响是( )
A.正、逆反应速率都减小,平衡不移动
B.正、逆反应速率都减小,平衡向正反应方向移动
C.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
D.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)二氧化硫的催化氧化的过程如图所示:
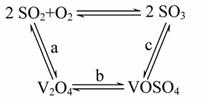
其中a、c二步的化学方程式可表示为____________
SO2+V2O5 SO3+V2O4
SO3+V2O4
4VOSO4+O2 2V2O5+4SO3
2V2O5+4SO3
该反应的催化剂是__________(写化学式)。
(2)550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关 系如图所示:
系如图所示:
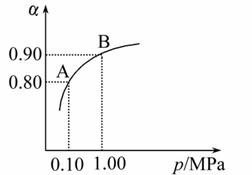
将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。试计算反应2SO3 2SO2+O2 在550 ℃时的平衡常数K=_________。
2SO2+O2 在550 ℃时的平衡常数K=_________。
(3)550 ℃时,将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,下列措施中能使n(SO3)/n(SO2)增大的是_____________。
A.升高温度
B.充入He(g),使体系总压强增大
C.再充入2.0 mol SO2和1.0 mol O2
(4)维持温度不变条件下使之发生如下反应:
2SO2+O2 2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等,如图所示:
2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等,如图所示:
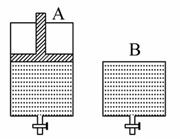
试填写下列空格:
A容器达到平衡时所需的时间比B容器___________(填“短”或“长”);平衡时A容器中SO2的转化率 比B容器_________(填“大”或“小”);达到所述平衡后,若向两容器中通入等物质的量的原反应气体,达到平衡时,A容器的混合气体中SO3的体积分数__________(填“增大”“减小”或“不变”,下同);B容器的混合气体中SO3的体积分数__________。
比B容器_________(填“大”或“小”);达到所述平衡后,若向两容器中通入等物质的量的原反应气体,达到平衡时,A容器的混合气体中SO3的体积分数__________(填“增大”“减小”或“不变”,下同);B容器的混合气体中SO3的体积分数__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的溶液加热蒸发至干、灼烧,所得固体的成分不相同的是
( )
A.FeCl2、FeCl3 B.FeCl2、Fe2(SO4)3
C.Na[Al(OH)4]、AlCl3 D.Mg(HCO3)2、MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)现有0.1 mol·L-1的纯碱溶液,试用pH试纸测定溶液的pH,其正确的操作是_______________________________________________________;
纯碱溶液呈碱性的原因是(用离子方程式表示)___________________________。
(2)为探究纯碱溶液呈碱性是由CO32-引起的,请你设计一个简单的实验方案:
__________________________________________________________________。
(3)为证明盐的水解是吸热反应,四位学生分别设计了如下方案,其中正确的是
_____________。
A.甲学生:在醋酸钠溶液中滴入2滴酚酞溶液,加热后红色加深,说明盐类水解是吸热反应
B.乙学生:在盐酸中加入氨水,混合液温度上升,说明盐类水解是吸热反应
C.丙学生:将硝酸铵晶体溶于水,水温下降,说明盐类水解是吸热反应
D.丁学生:在氨水中加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热反应
B项中和反应本身是放热反应,C项是因为NH4NO3溶于水吸热,D项是因为NH4Cl抑制NH3·H2O 的电离而使pH变小
查看答案和解析>>
科目:高中化学 来源: 题型:
现有X、Y、Z、W四种短周期主族元素,原子半径X>Y>Z>W,X、Y、Z处于同一周期,Z、W处于同一主族,X、Y、Z的原子序数之和为40,最外层电子数之和为10,下列说法正确的是( )
A.Y的最高价氧化物对应的水化物一定是强碱
B.Z一定位于ⅦA族
C.若X、Y、W形成的化合物为XYW2,则其水溶液显碱性
D.X与足量的W反应生成的化合物为X2W
查看答案和解析>>
科目:高中化学 来源: 题型:
若以ω1和ω2分别表示浓度为amol•L﹣1和bmol•L﹣1氨水的质量分数,且知2a=b,则下列推断正确的是(氨水的密度比纯水的小)( )
|
| A. | 2ω1=ω2 | B. | 2ω2=ω1 | C. | ω2>2ω1 | D. | ω1<ω2<2ω1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com