
下列说法正确的是( )
|
| A. | Na2O2与水的反应中,氧化剂是Na2O2,还原剂是水 |
|
| B. | 向硅酸钠溶液中滴加盐酸,有白色凝胶生成 |
|
| C. | 向AlCl3溶液中逐滴滴加氨水至过量,先出现白色沉淀后溶解 |
|
| D. | 工业上可以电解氯化镁溶液制取金属镁 |
| 钠的重要化合物;含硅矿物及材料的应用;镁、铝的重要化合物.. | |
| 专题: | 元素及其化合物. |
| 分析: | A、根据过氧化钠和水反应时化合价的变化来回答; B、盐酸和硅酸钠反应生成难溶性的硅酸; C、向AlCl3溶液中加氨水:AlCl3+3NH3•H2O=Al(OH)3↓+3NH4Cl,逐渐产生沉淀,氢氧化铝只与强碱反应,所以沉淀不溶解; D、活泼金属采用电解其熔融盐或氧化物的方法冶炼. |
| 解答: | 解:A、过氧化钠和水的反应为:2Na2O2+2H2O=4NaOH+O2,化合价变化的只有过氧化钠中的氧元素,过氧化钠中的氧元素从﹣1价降为﹣2价,同时升为0价,所以Na2O2既是氧化剂又是还原剂,故A错误; B、盐酸是强酸,硅酸为弱酸,盐酸和硅酸反应:2HCl+Na2SiO3═2NaCl+H2SiO3↓,有白色凝胶硅酸生成,故B正确; C、向AlCl3溶液中加氨水:AlCl3+3NH3•H2O=Al(OH)3↓+3NH4Cl,逐渐产生沉淀,氢氧化铝只与强碱反应,所以沉淀不溶解,故C错误; D、Mg是活泼金属,工业上采用电解熔融氯化镁的方法冶炼,如果电解氯化镁溶液,阴极上氢离子放电而不是镁离子反应,所以得不到Mg单质,故D错误; 故选B. |
| 点评: | 本题考查了物质的现在,涉及金属的冶炼、氧化还原反应、氢氧化铝的两性等知识点,明确物质的性质即可解答,知道常见元素化合物的性质,题目难度不大. |


科目:高中化学 来源: 题型:
实验室中需要配制2 mol·L-1的NaCl溶液950 mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )
A.950 mL,111.2 g B.500 mL,117 g C.1 000 mL,117 g D.任意规格,111.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
对于溶液中某些离子的检验及结论一定正确的是( )
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,一定有CO32-
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
C.加入足量稀盐酸,再加入氯化钡溶液后有白色沉淀产生,一定有SO42-
D.加入碳酸钠溶液产生白色沉淀,再加盐酸沉淀消失,一定有Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸.向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面.已知:2KMnO4+16HCl→2KCl+5Cl2↑+2MnCl2+8H2O
对实验现象的“解释或结论”正确的是( )
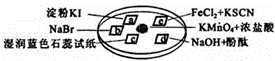
| 选项 | 实验现象 | 解释或结论 |
| A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
| B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
| C | d处立即褪色 | 氯气与水生成了漂白性物质 |
| D | e处变红色 | 还原性:Fe2+>Cl﹣ |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
|
| A. | 向40 mL 8 mol/L的硝酸溶液中加入5.6 g铁粉Fe+4H++N03﹣═Fe3++NO↑+2H2O |
|
| B. | 少量SO2通入Ca(ClO)2溶液中SO2+H2O+Ca2++2ClO﹣═CaSO3↓+2HClO |
|
| C. | 漂白粉溶液在空气中失效ClO﹣+CO2+H2O═HClO+HCO3﹣ |
|
| D. | Ba(OH)2溶液中滴加NaHSO4溶液至中性Ba2++2OH﹣+2H++SO42﹣═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
为了降低电子垃圾对环境构成的影响,将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
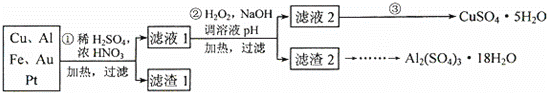
(1)第①步Cu与混酸反应的离子方程式为 .得到滤渣1的主要成分为 .
(2)第②步中加入H2O2的作用是 ,使用H2O2的优点是 ;调溶液pH的目的是 .
(3)简述第③步由滤液2得到CuSO4•5H2O的方法是 .
(4)由滤渣2制取Al2(SO4)3•18H2O,设计了以下三种方案:
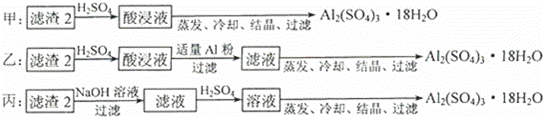
上述三种方案中, 方案不可行,原因是 ;从原子利用率角度考虑, 方案更合理.
(5)用滴定法测定CuSO4•5H2O含量.取a g试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用
c mol/L EDTA(H2Y2﹣)标准溶液滴定至终点,平均消耗EDTA溶液b mL.滴定反应如下:
Cu2++H2Y2﹣→CuY2﹣+2H+.写出计算CuSO4•5H2O质量分数的表达式ω= .
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.1 mol的KCl和0.1 mol的AlCl3溶于水配成100mL混合溶液,下列溶液中Cl-浓度
与该溶液浓度相等的是
A. 3 mol·L-1 的NaCl溶液 B. 2mol·L-1 的FeCl3溶液
C. 2 mol·L-1 的MgCl2溶液 D. 2 mol·L-1 的NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
用下图所示装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
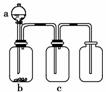
| 气体 | a | b | c | |
| A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| B | SO2 | 浓硫酸 | Cu | 酸性KMnO4溶液 |
| C | CO2 | 稀盐酸 | CaCO3 | 浓硫酸 |
| D | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com