
| A. | 已知298K时氢氰酸(HCN)的Ka=4.9×10-10,碳酸的Ka1=4.4×10-7,Ka2=4.7×10-11,据此可推测将氢氰酸加入到碳酸钠溶液中不可能观察到有气泡产生 | |
| B. | 25℃时,将amol•L氨水与0.01mol•L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(CI-),用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ | |
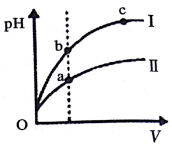
| C. | 某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线如图所示.II为醋酸稀释时pH的变化曲线,且a、b两点水的电离程度:a<b | |
| D. | 向0.10mol•L-1NaHSO4溶液中通入NH3至溶液pH=7(通入气体对溶液体积的影响可忽略):c(Na+)>c(SO42-)>c(NH4+) |
分析 A.相同温度、浓度下,酸的电离平衡常数越大,酸的酸性越强,其酸根离子的水解能力越小,结合强酸制取弱酸分析解答;
B.在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得n(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,NH3•H2O的电离常数Kb=$\frac{c(O{H}^{-})×c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$;
C.醋酸为弱酸,存在电离平衡,当加水稀释时,氢离子浓度减小较慢,以此判断醋酸稀释时,pH的变化曲线;氢离子浓度越大,对水的电离的抑制程度越大;
D.根据电荷守恒分析.
解答 解:A.已知298K时氢氰酸(HCN)的Ka=4.9×10-10,碳酸的Ka1=4.4×10-7,Ka2=4.7×10-11,则酸性H2CO3>HCN>HCO3-,所以氢氰酸加入到碳酸钠溶液中,没有气体生成,故A正确;
B.在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得n(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,NH3•H2O的电离常数Kb=$\frac{c(O{H}^{-})×c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{1{0}^{-7}×5×1{0}^{-3}}{0.5{a}^{-5}×1{0}^{-3}}$=$\frac{1{0}^{-9}}{a-0.01}$,故B正确;
C.醋酸为弱酸,存在电离平衡,当加水稀释时,氢离子浓度减小较慢,所以醋酸稀释时,pH增大较慢,曲线Ⅱ为醋酸的pH值变化;氢离子浓度越大,对水的电离的抑制程度越大,且a中溶液的pH小,即氢离子浓度大,所以a点水的电离程度小,则a、b两点水的电离程度:a<b,故C正确;
D.向0.10mol•L-1NaHSO4溶液中通入NH3至溶液pH=7,溶液中电荷守恒为:c(Na+)+c(NH4+)+c(H+)=2c(SO42-)+c(OH-),由于显中性,即c(H+)=+c(OH-),所以c(Na+)+c(NH4+)=2c(SO42-),已知c(Na+)=c(SO42-),所以c(Na+)=c(SO42-)=c(NH4+),故D错误.
故选D.
点评 本题考查了弱电解质的电离、溶液中离子浓度大小比较,题目难度中等,注意掌握弱电解质电离的特点及其应用,能够根据电荷守恒、物料守恒、盐的水解原理等知识判断溶液中离子浓度大小.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 任何气体单质在标准状况下体积约为22.4L,则一定含有2NA个原子 | |
| B. | 常温常压下,22g氧气和26g臭氧所含氧原子总数为3NA | |
| C. | 常温常压下,22.4LH2O中含有的氢原子数为2NA | |
| D. | 标准状况下,0.3molCO2中含有氧原子数0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
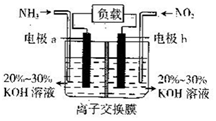 利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减少环境污染,又能充分利用化学能,装置如图所示.下列说正确是( )
利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减少环境污染,又能充分利用化学能,装置如图所示.下列说正确是( )| A. | 电流从电极a经过负载后流向电极b | |
| B. | 为使电池持续放电,离子交换膜只允许阴离子通过 | |
| C. | 电极a的电极反应式为2NH3-6e-=N2+6H- | |
| D. | 室温下,当有4.48 L NO2被处理时,转移电子为0.8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃,Cu(OH)2在水中的溶度积比其在 Cu(NO3)2溶液中的大 | |
| B. | 一定温度下,将 0.10mol•L-1的氨水加水稀释,溶液中各离子浓度均减小 | |
| C. | H3PO2属于一元弱酸,则H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+OH-═H2PO2-+H2O | |
| D. | 常温下,NaHS溶液中:c(H+)+c(H2S)+c(Na+)=c(S2-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
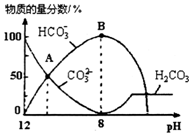 25℃时,H2CO3的Kal=4.2×10-7,Ka2=5.6×10-11.室温下向10mL 0.1mo1•L-1Na2CO3溶液中逐滴加入0.1mo1•L-1HCl溶液.如图是溶液中含碳元素微粒物质的量分数随pH降低而变化的图象(CO2因有逸出未画出).下列说法错误的是( )
25℃时,H2CO3的Kal=4.2×10-7,Ka2=5.6×10-11.室温下向10mL 0.1mo1•L-1Na2CO3溶液中逐滴加入0.1mo1•L-1HCl溶液.如图是溶液中含碳元素微粒物质的量分数随pH降低而变化的图象(CO2因有逸出未画出).下列说法错误的是( )| A. | A点所示溶液的pH<11 | |
| B. | B点所示溶液:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) | |
| C. | A点→B点发生反应的离子方程式为CO32-+H+═HCO3- | |
| D. | 分步加入酚酞和甲基橙,用滴定法可测定Na2CO3与NaHCO3混合物的组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性溶液中:Mg2+、K+、SO42-、NO3- | |
| B. | 无色溶液中:Na+、A13+、NO3-、MnO4- | |
| C. | FeCl溶液中:Na+、NH4+、SCN-,SO42- | |
| D. | 与A1反应放出H2的溶液中:NH4+、Na+、NO3-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾、氯化铁晶体可用于净水 | |
| B. | 实验室通常可使用热的纯碱溶液去除油污 | |
| C. | 实验室配制FeCl3溶液时可加入少量盐酸 | |
| D. | 直接加热CuCl2溶液能得到CuCl2固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓碱飞溅到皮肤上,应立刻涂上硫酸溶液 | |
| B. | 金属钠着火,立刻用水扑灭 | |
| C. | 实验剩余氯气可直接排放到实验室外 | |
| D. | 加热试管时,先来回移动酒精灯加热,再对准药品集中加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com