

分析 (1)①图1为原电池反应,Fe为负极,发生:Fe-2e-=Fe2-,石墨为正极,发生2H++2e-=H2↑;原电池中阴离子向负极移动;
②Fe和H2SO4构成原电池或电解池时,Fe作负极或阳极,结合电解池和原电池的原理分析回答;
(2)①放电时,K2FeO4在正极上得电子发生还原反应生成Fe(OH)3;
②以Fe作阳极,以Cu作阴极,对足量KOH溶液进行电解,阴极氢离子得电子生成氢气,2H++2e-=H2↑,根据转移电子守恒计算生成氢气.
解答 解:(1)①图中为原电池反应,Fe为负极,发生:Fe-2e-=Fe2-,石墨为正极,发生2H++2e-=H2;原电池中阴离子向负极移动,所以左侧烧杯中的c(Cl-)增大;
故答案为:2H++2e-=H2;增大;
②Fe和H2SO4之间的反应,如果设计电解池实现,金属铁作阳极,阳极:Fe-2e-=Fe2+,电解质为硫酸,阴极是氢离子放电,电极反应为2H++2e-=H2↑,即阳极为铁,阴极为C;如果设计原电池实现,金属铁作负极,负极:Fe-2e-=Fe2+,电解质为硫酸,正极是氢离子放电,电极反应为2H++2e-=H2↑,即负极为铁,正极为C;
故答案为:甲:左边为Fe,右边为C;乙:左边为Fe,右边为C;
(2)①放电时,K2FeO4在正极上得电子发生还原反应生成Fe(OH)3,则正极的电极反应式为FeO42-+3e-+4H2O═Fe(OH)3+5OH-,
故答案为:FeO42-+3e-+4H2O═Fe(OH)3+5OH-;
②以Fe作阳极,以Cu作阴极,对足量KOH溶液进行电解,阴极氢离子得电子生成氢气,2H++2e-=H2↑,当电池中有0.2molK2FeO4反应时,转移0.6mol电子,则生成0.3mol氢气,其体积为6.72L;
故答案为:6.72.
点评 本题考查了原电池原理和电解池原理的应用,根据元素化合价变化确定正负极、阴阳极上发生的反应,难点是电极反应式的书写和电子守恒在计算中的应用,题目难度中等.


科目:高中化学 来源: 题型:解答题
 +
+ $\stackrel{OH-}{→}$
$\stackrel{OH-}{→}$
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是吸热反应 | B. | 是放热反应 | ||
| C. | 是熵减小的反应 | D. | 熵增大效应大于能量效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子半径:A<B<C<D | |
| B. | 非金属性:A<C | |
| C. | 最高价氧化物对应水化物的酸性:D>C | |
| D. | B的最高价氧化物对应的水化物为强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
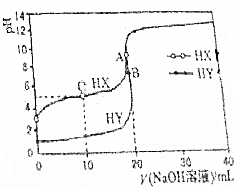 25℃时,用浓度为0.1000mol•L-1的NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的盐酸和醋酸溶液的滴定曲线如图所示(混合溶液体积变化忽略不计).下列说法不正确的是( )
25℃时,用浓度为0.1000mol•L-1的NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的盐酸和醋酸溶液的滴定曲线如图所示(混合溶液体积变化忽略不计).下列说法不正确的是( )| A. | 根据滴定曲线,可得Ka(CH3COOH)≈10-5 | |
| B. | pH=7时,滴定醋酸溶液消耗的V(NaOH溶液)<20mL | |
| C. | C点溶液:c(HX)>c(X-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 当V(NaOH溶液)=20mL时,A点水电离出c(H+)大于B点水电离出的c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与氯气混合后在光照的条件下发生反应 | |
| B. | 甲苯与Br2发生反应 | |
| C. | 乙炔与氢气的加成反应 | |
| D. | 乙烯与氯化氢的加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com