
【题目】某Al2O3样品中含有一定量的Cu、Fe、Fe2O3杂质。现通过下列生产过程,从该样品中提纯Al2O3,并回收铁红。流程如下:
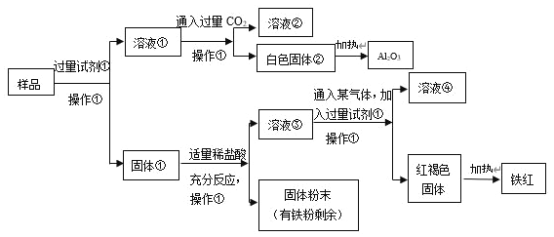
(1)操作①是_________,在实验室进行该操作需要的玻璃仪器有_________。
(2)白色固体②是_________,样品和试剂①反应的化学方程式是_________。
(3)固体①加入适量稀盐酸,可能发生的反应有:_______(用化学方程式表达)。
(4)溶液③中铁元素的存在形式是_________,如何用实验证明:____。
(5)溶液③中通入某气体,该气体可以是_________(任写一种的化学式),红褐色固体制得铁红的化学方程式是_________。
【答案】过滤 烧杯、漏斗、玻璃棒 Al(OH)3 Al2O3+2NaOH=2NaAlO2+H2O Fe2O3+6HCl=2FeCl3+3H2O、2FeCl3+Fe=3FeCl2、Fe+2HCl=FeCl2+H2↑ Fe2+ 取少量溶液于试管中,滴入KSCN溶液无变化,滴加氯水后变血红色 O2或者Cl2 2Fe(OH)3![]() Fe2O3+3H2O
Fe2O3+3H2O
【解析】
Al2O3样品中含有一定量的Cu、Fe、Fe2O3杂质,根据题中流程图可知,样品与试剂①反应得溶液①再通入CO2得白色沉淀②,该白色固体加热分解产生Al2O3,可推知试剂①为NaOH,得到的固体①为Cu、Fe、Fe2O3,溶液①为NaAlO2、NaOH混合溶液,通入过量CO2后得溶液②为NaHCO3溶液,白色固体②为Al(OH)3,Al(OH)3受热分解得Al2O3,固体①中加入盐酸得到固体粉末中铁有剩余,由于Fe会发生反应2Fe3++Fe=3Fe2+,则溶液③中主要含有Fe2+,经过操作①得红褐色固体应为Fe(OH)3,所以通入的气体应为氧化剂,可以是O2或Cl2,氢氧化铁受热分解得Fe2O3。
(1)操作①是分离难溶性固体与可溶性液体混合物的方法,名称为过滤;在实验室进行过滤操作需要的玻璃仪器有烧杯、漏斗、玻璃棒;
(2)白色固体②受热分解产生Al2O3,则②是Al(OH)3,样品中含有Al2O3和试剂NaOH溶液反应产生NaAlO2和H2O,反应的化学方程式是Al2O3+2NaOH=2NaAlO2+H2O;
(3)固体①中含有Al2O3、Cu、Fe、Fe2O3,加入适量稀盐酸,由于反应后的固体粉末中含有Fe单质,则可能发生的反应有Fe2O3+6HCl=2FeCl3+3H2O、2FeCl3+Fe=3FeCl2、Fe+2HCl=FeCl2+H2↑;
(4)由于固体①中样品与适量盐酸反应后的固体粉末中含有Fe,结合Fe2O3+6HCl=2FeCl3+3H2O、2Fe3++Fe=3Fe2+可知溶液③中铁元素的存在形式是Fe2+,证明方法是:取少量该溶液于试管中,滴入KSCN溶液无变化,滴加氯水后溶液变血红色;
(5)溶液③中含有Fe2+,向溶液③通入某气体后再加入足量NaOH溶液,产生红褐色的Fe(OH)3沉淀,该气体具有强的氧化性,气体可以是O2或者Cl2,红褐色固体Fe(OH)3不稳定,受热分解产生铁红Fe2O3,该反应的化学方程式是2Fe(OH)3![]() Fe2O3+3H2O。
Fe2O3+3H2O。


科目:高中化学 来源: 题型:
【题目】制取Na2CO3和高纯Si的工艺流程如图所示,下列说法错误的是
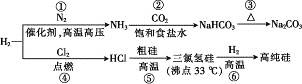
A. 反应①属于固氮反应
B. 步骤②为先向饱和食盐水中通入CO2至饱和后,再通入NH3
C. 反应⑤、⑥均为氧化还原反应
D. 用精馏的方法可提纯三氯氢硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修3:物质的结构与性质)
钛有“生物金属”和“未来金属”之称,钛及其化合物的应用正越来越受到人们的关注。
(1)基态钛原子外围电子的轨道表达式为___________。与钛同周期的元素中,基态原子的未成对电子数与钛相同的有___种。
(2)金属钛的熔点、硬度均比铝大,可能的原因是____。
(3)TiCl4是氯化法制取钛的中间产物。TiCl4和SiCl4在常温下都是液体,分子结构相同。采用蒸馏的方法分离TiCl4和SiCl4的混合物,先获得的馏分是__________ (填化学式)。

(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯等的聚合,其结构如图所示。
①组成该物质的元素中,电负性最大的是__________ (填元素名称)。
②M中碳原子的杂化形式有___________种。
③M中不含__________ (填字母代号)。
a.π键 b.σ键 c.配位键
d.氢键 e.离子键

(5)①金属钛晶体中原子采用面心立方最密堆积,则晶胞中钛原子的配位数为_____。
②设钛原子的直径为d cm,用NA表示阿伏加德罗常数的值,钛原子的摩尔质量为M g·mol-1,则晶体钛的密度为________g·cm-3。
③金属钛晶胞中有若干个正四面体空隙,如图中a、b、c、d四个钛原子形成一个正四面体,其内部为正四面体空隙,可以填充其他原子。若晶胞中所有的正四面体空隙中都填充氢原子,那么形成的氢化钛的化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列叙述正确的是
A. 18 g D2O中含有的质子数为10NA
B. 60 g二氧化硅中含有的Si—O键数目为4NA
C. 密闭容器中,2 mol NO与1 mol O2充分反应,产物的分子数为2NA
D. 标准状况下,22.4 L氯气通入足量水中充分反应后转移电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(举一反三)下列说法正确的是( )
A.在稀硫酸中加入铜粉,铜粉不溶解,再加入Cu(NO3)2固体,铜粉仍不溶解
B.铜与浓硝酸反应的离子方程式为Cu+4H++2NO![]() ===Cu2++2NO2↑+2H2O
===Cu2++2NO2↑+2H2O
C.1.0 mol·L-1的KNO3溶液中可大量存在H+、Fe2+、Cl-、SO![]()
D.硫化铜溶于硝酸的离子方程式为CuS+2H+===H2S↑+Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固定容积为1L的密闭容器中,1molA(g)与1molB(g)在催化剂作用下加热到500℃发生反应:A(g)+B(g)![]() C(g)+2D(s) ΔH>0,下列有关说法正确的是
C(g)+2D(s) ΔH>0,下列有关说法正确的是
A. 升高温度,![]() 增大,
增大,![]() 逆减小
逆减小
B. 平衡后再加入1molB,上述反应的ΔH增大
C. 通入稀有气体,压强增大,平衡向正反应方向移动
D. 若B的平衡转化率为50%,则该反应的平衡常数等于2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示。下列说法正确的是( )
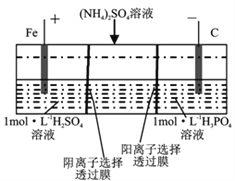
A. 阳极室溶液由无色变成棕黄色
B. 阴极的电极反应式为:4OH--4e-=2H2O+O2↑
C. 电解一段时间后,阴极室溶液中的pH升高
D. 电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.中国传统文化是人类文明的瑰宝,古代文献中记载了大量古代化学的研究成果。回答下面问题:
(1)我国最原始的陶瓷约出现在距今12000年前,制作瓷器所用的原料是高岭士,其晶体化学式是Al4[Si4O10](OH)8,用氧化物表示其组成为______________。
(2)《本草纲目》中记载:“(火药)乃焰消( KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者。”反应原理为:S+2KNO3+3C![]() K2S+N2↑+3CO2↑,该反应的氧化剂是____ ,反应转移4mol电子时,被S氧化的C有____mol。
K2S+N2↑+3CO2↑,该反应的氧化剂是____ ,反应转移4mol电子时,被S氧化的C有____mol。
(3)我国古代中药学著作《新修本草》记载的药物有844种,其中有关“青矾”的描述为:“本来绿色,新出窟未见风者,正如瑁璃…烧之赤色…。”我国早期科技丛书《物理小适-金石类》 记载有加热青矾时的景象:“青矾厂气熏人,衣服当之易烂,载木不盛。”青矾就是绿矾( FeSO4·7H2O)。根据以上信息,写出“青矾”受热分解的化学方程式_________________。
Ⅱ.“钢是虎,钒是翼,钢含钒犹如虎添翼”,钒是“现代工业的味精”。钒对稀酸是稳定的,但室温下能溶解于浓硝酸中生成VO2+。
(4)请写出金属钒与浓硝酸反应的离子方程式:_______________________________。
(5)V2O5是两性氧化物,与强碱反应生成钒酸盐(阴离子为VO43-),溶于强酸生成含钒氧离子(VO2+)的盐。请写出V2O5分别与烧碱溶液和稀硫酸反应生成的盐的化学式:_____________、 _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+,他们使用的药品和装置如下图所示,下列说法不合理的是( )
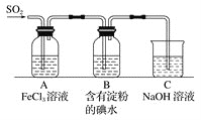
A.能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
B.装置C的作用是吸收SO2尾气,防止污染空气
C.为了验证A中发生了氧化还原反应,加入KMnO4溶液,紫红色褪去
D.为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com