
科目:高中化学 来源: 题型:选择题
| A. | 四种溶液中的KW相同,由水电离出的c(H+):①=②=③=④ | |
| B. | 取体积相同的溶液①、②、③分别与足量铝粉反应,生成H2的量:①最少 | |
| C. | 将等体积的四种溶液分别稀释100倍,所得溶液的pH:③>④>②>① | |
| D. | 常温下,将②和③等体积混合:c(CH3COO-)-c(Na+)=c(H+)-c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
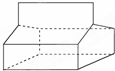 篮烷的结构如图所示:
篮烷的结构如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
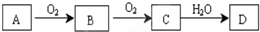
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | B | ||||||
| 2 | D | E | F | G | ||||
| 3 | C | H | I |
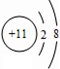 ,I的原子结构示意图
,I的原子结构示意图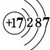 .
.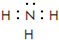 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
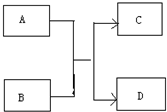 运用有关知识,回答下列问题.
运用有关知识,回答下列问题.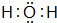 ,实验室中检验C的试剂及现象是湿润的红色石蕊试纸变蓝色.
,实验室中检验C的试剂及现象是湿润的红色石蕊试纸变蓝色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得溶液中C(Fe2+):C(Fe3+)=1:1 | B. | 所得溶液中C(NO3-)=2.75mol/L | ||
| C. | 反应后生成NO的体积为28 L | D. | 所得溶液中溶质只有FeSO4和K2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com