
【题目】在某100 mL混合酸溶液中,HNO3和H2SO4的物质的量浓度分别为0.2 mol·L-1和0.4 mol·L-1,向该混合溶液中加入2.24 g铁粉,加热充分反应后,下列说法不正确的是
A. 生成的气体在标准状况下的体积为672 mLB. 生成的气体有NO和H2
C. 所得溶液中有溶质FeSO4和Fe2(SO4)3D. 所得溶液中Fe2+的物质的量浓度为0.4 mol·L-1
【答案】C
【解析】
计算氢离子总物质的量、硝酸根的物质的量判断,铁粉和氢离子过量,根据反应:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O、Fe+2H+═Fe2++H2↑进行过量计算,根据不足量的硝酸根计算生成NO物质的量,根据铁粉和氢离子过量进而计算生成氢气的物质的量,进而计算Fe2+的物质的量浓度。
n(HNO3)=cv=0.2molL1×0.100 L=0.020mol, n(H2SO4)=cv=0.4molL1×0.100 L=0.040mol,100mLHNO3和H2SO4混合酸溶液中,n(H+)=0.02moL+2×0.04moL=0.10mol,n(NO3)=0.020mol,n(Fe)=![]() =
=![]() =0.040mol,
=0.040mol,
所以向该混合液中加入2.24g铁粉,加热先发生反应:
3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O
物质的量:0.03 0.08 0.02 0.03 0.02
反应后剩余的0.02molH+发生下列反应:
Fe+2H+═Fe2++H2↑
物质的量:0.01 0.02 0.01 0.01,则
A. 生成的气体有NO和H2共0.03mol,生成的气体在标准状况下的体积为V=n×![]() Vm=0.03mol×22.4L/mol=672mL,A项正确;
Vm=0.03mol×22.4L/mol=672mL,A项正确;
B. 根据以上分析生成的气体有NO和H2,B项正确;
C. 因NO3少量所得溶液中溶质只有FeSO4,C项错误;
D. 溶液中Fe2+的物质的量为:0.03 mol+0.01 mol=0.04 mol,100mL混合酸溶液中,浓度为c= ![]() = 0.4molL1,D项正确;
= 0.4molL1,D项正确;
答案选C。


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
【题目】醋酸镍((CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:

相关离子生成氢氧化物的pH和相关物质的溶解性如下表:

(1)粉碎含镍废料的作用__________________________________
(2)酸浸过程中,l molNiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式:___。
(3)写出氧化步骤中加入H2O2发生反应的离子方程式:____。
(4)调节pH除铁、铝步骤中,溶液pH的调节范围是____。
(5)滤渣3主要成分的化学式是____。
(6)沉镍过程中,若c(Ni2+)= 2.0 mol.L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5 mol·L-1],则需要加入Na2CO3固体的质量最少为____g(保留一位小数)。
(7)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为____℃、______min。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 由C(石墨) = C(金刚石) △H=+1.9 kJ·mol-1可知,金刚石比石墨稳定
B. 在一定条件下,等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
C. 已知2C(s) + O2(g) = 2CO(g) △H=-221 kJ·mol-1,可知C的标准燃烧热为110.5 kJ·mol-1
D. 在一密闭容器中,9.6 g的硫粉与11.2 g的铁粉混合加热,充分反应,生成硫化亚铁17.6 g,放出19.12 kJ的热量,则Fe(s) + S(s) = FeS(s) △H= - 95.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】混合动力汽车(HEV) 中使用了镍氢电池,其工作原理如图所示:其中M 为储氢合金,MH 为吸附了氢原子的储氢合金,KOH 溶液作电解液。关于镍氢电池,下列说法不正确的是

A. 充电时,阴极附近pH 降低
B. 电动机工作时溶液中OH-向甲移动
C. 放电时正极反应式为:NiOOH+H2O+e- =Ni(OH)2+OH-
D. 电极总反应式为:MH+NiOOH![]() M+Ni(OH)2
M+Ni(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子可大量共存且溶液无色的是( )
A. Cu2+、SO42-、Fe3+、Cl- B. Na+、NO3-、K+、SO42-
C. MnO4-、Al3+、Na+、SO42- D. Fe2+、H+、ClO-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到的滤液用 NaHCO3溶液处理,测得溶液pH、n[Al(OH)3]随加入NaHCO3溶液体积变化的曲线如下图所示。下列有关说法不正确的是
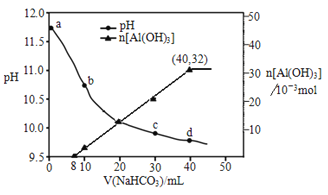
A. 生成沉淀的离子方程式为HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-
B. b 点与c点溶液所含微粒种类相同
C. a 点溶液中大量存在的离子是Na+、AlO2-、OH-
D. NaHCO3溶液的物质的量浓度为0.8mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于二氧化硅的说法中错误的是 ( )
A.二氧化硅分子是由一个硅原子和两个氧原子构成的
B.在二氧化硅晶体中,每个硅原子与4个氧原子相连
C.石英、水晶、玛瑙的主要成分都是二氧化硅
D.自然界中二氧化硅主要存在于石英矿和硅酸盐中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质的方法不正确的是( )
A.除去乙烷中少量的乙烯:气体通入足量溴水
B.除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤、分液
C.除去苯中少量苯酚:加入溴水,过滤
D.除去乙醇中少量的乙酸:加足量生石灰、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
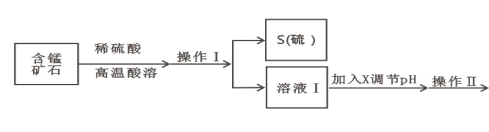
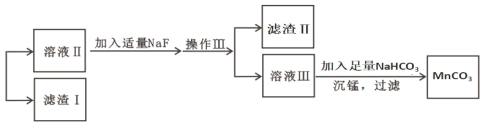
【题目】某含锰矿石的主要成分是 MnO2,还含 CaO、Al2O3、FeS 杂质,由此矿石生产 MnCO3 的工艺流 程如图所示:
已知:①相关金属离子生成氢氧化物沉淀的 pH 如表所示:
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.8 | 4.7 |
Mn(OH)2 | 8.8 | 10.4 |
Ca(OH)2 | 12 | ─ |
②常温下,Ksp(CaF2)=3.95×10-11
回答下列问题:
(1)酸溶时,是否能将稀硫酸换成浓盐酸_____(填“ 是” 或“ 否” );操作 I 的名称 为_____。
(2)取溶液Ⅰ加入 KSCN 溶液,溶液呈血红色,试写出酸溶过程中 MnO2 与 FeS 发生反应的离子方程 式:_____。
(3)调节溶液Ⅰ的 pH 时,pH 的范围为_____;所用的物质 X 最好是_____(填字母)。
A.盐酸 B.NaOH 溶液 C.氨水 D.MnCO3 固体
(4)滤渣Ⅰ为_____,滤渣Ⅱ为_____。(填化学式)
(5)沉锰的化学方程式为_____。
(6)沉锰后过滤得到固体 MnCO3,设计实验方案验证 MnCO3 固体是否洗涤干净:_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com