
 H+ + HS-
H+ + HS- H+ + S2- (2)①< ②4 ③c(H+)> c(Br-)> c(SO42-)>c(OH-)
H+ + S2- (2)①< ②4 ③c(H+)> c(Br-)> c(SO42-)>c(OH-) H+ + HS- HS-
H+ + HS- HS- H+ + S2-;(2)①根据同主族元素性质递变规律:同主族元素最高价氧化物水化物的酸性由上到下逐渐增强知:酸性强弱 H3AsO4 <H3PO4。②S位于VIA族,最高正价为+6价,负价为-2价,代数和为4;根据同主族元素由上到下单质与氢化合越来越难知在相同条件下Se与H2反应的限度比S与H2反应限度更小;③将SO2气体通入溴水恰好完全反应离子方程式为Br2 + SO2 +2H2O=2Br- + 2H+ + SO42-,溶液中存在的离子浓度由大到小的顺序是c(H+)> c(Br-)> c(SO42-)>c(OH-)。
H+ + S2-;(2)①根据同主族元素性质递变规律:同主族元素最高价氧化物水化物的酸性由上到下逐渐增强知:酸性强弱 H3AsO4 <H3PO4。②S位于VIA族,最高正价为+6价,负价为-2价,代数和为4;根据同主族元素由上到下单质与氢化合越来越难知在相同条件下Se与H2反应的限度比S与H2反应限度更小;③将SO2气体通入溴水恰好完全反应离子方程式为Br2 + SO2 +2H2O=2Br- + 2H+ + SO42-,溶液中存在的离子浓度由大到小的顺序是c(H+)> c(Br-)> c(SO42-)>c(OH-)。

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题

| A.热稳定性:Y的气态氢化物<Z的气态氢化物 |
| B.X的最高价氧化物对应水化物的酸性比Y的强 |
| C.X元素的单质能与所有强酸发生反应放出H2 |
| D.R元素的单质化学性质活泼 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | Si | P | S | Cl |
| 单质与氢气 反应的条件 | 高温 | 磷蒸气与氢气能反应 | 加热 | 光照或点燃时发生爆炸而化合 |
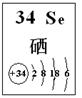
| 编号 | 性质推测 | 化学方程式 |
| 1 | 氧化性 | H2SeO3+4HI=Se↓+2I2+3H2O |
| 2 | | |
| 3 | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


| A.最高正化合价为+6价, | B.气态氢化物比H2S稳定, |
| C.最高价氧化物的水化物的酸性比硫酸弱, | D.单质在常温下可与氢气化合。 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
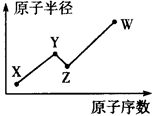
| A.上述三种元素的原子半径大小为Y<X<W |
| B.W、X、Y原子的核外最外层电子数的总和为10 |
| C.由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
| D.W与Y可形成既含极性共价键又含非极性共价键的化合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Y与Z的最高正价之和等于9 |
| B.Y的气态氢化物比W的稳定 |
| C.原子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z) |
| D.XY2与ZY2中的化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电负性:As>Cl>P | B.热稳定性:HCl>HBr>AsH3 |
| C.第一电离能:Br>Se>As | D.酸性:H3AsO4>H2SO4>H3PO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com