
| A. | 混合气体的颜色不再改变 | B. | 混合气体的密度不再改变 | ||
| C. | 混合气体的压强不再改变 | D. | 混合气体的平均分子质量不再改变 |
分析 当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量不变,注意该反应是一个反应前后气体体积不变的化学反应,所以不能用压强判断平衡.
解答 解:A、混合气体的颜色不再改变,说明碘蒸气的浓度不变,反应达平衡状态,故A正确;
B、气体质量和体积是一个定值,所以混合气体的密度一直不变,故B错误;
C、两边气体计量数相等,所以混合气体的压强一直不变,故C错误;
D、混合气体的质量不变,物质的量不变,所以混合气体的平均分子质量一直不变,故D错误;
故选A.
点评 本题考查了化学平衡状态的判断,难度不大,注意反应前后气体体积不变的化学反应不能用压强来判断是否达到平衡状态.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
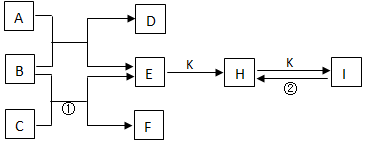
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | 仅②③ | C. | ②③④ | D. | 仅④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)=2c(S2-)+2c(HS-)+2c(H2S) | B. | c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) | ||
| C. | c(Na+)>c(S2-)>c(OH-)>c(HS-) | D. | c(OH-)=c(H+)+c(HS-)+c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素为Mn元素 | B. | 该元素最高化合价为+7 | ||
| C. | 该元素属于d区元素 | D. | 该元素原子最外层共有7个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
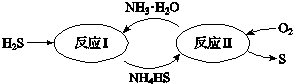
 .
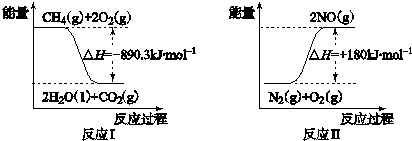
.
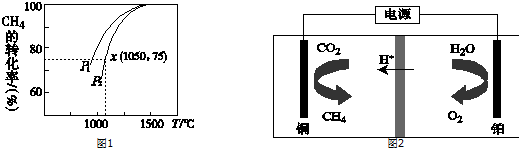
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①中电能转化为化学能 | |
| B. | 反应②为放热反应 | |
| C. | 反应③使用催化剂,△H3减小 | |
| D. | 反应②中,反应物的键能大于生成物的键能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com