
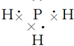 ,结构式
,结构式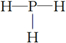 .
.分析 ①NH3属于共价化合物,不存在离子键,分子中存在3对共用电子对,氮原子最外层为8个电子,PH3与NH3结构相似,注意PH3的电子式书写不能漏掉一对孤对电子对,结构式共用电子对用短线表示;
②价层电子对个数=σ 键+孤电子对个数,PH3杂化轨道数是4,空间构型为三角锥形;
③三个σ键和一个孤对电子对,所以中心原子采取sp3杂化.
④PH3分子中的化学键不同原子形成的共价键是极性键,其分子正负电荷中心不重合,结构不对称,为极性分子;
⑤非金属性越强,氢化物越稳定,PH3与NH3的热稳定性:NH3 更强.
解答 解:①NH3属于共价化合物,不存在离子键,分子中存在3对共用电子对,氮原子最外层为8个电子,氨气的电子式为 ,PH3与NH3结构相似,所以PH3的电子式为:
,PH3与NH3结构相似,所以PH3的电子式为: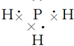 ,结构式共用电子对用短线表示,所以结构式为:
,结构式共用电子对用短线表示,所以结构式为: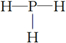 ,
,
故答案为: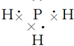 ;
;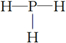 ;
;
②PH3分子中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(5-3×1)=4,所以磷原子采用sp3杂化,含有一对孤对电子,属于三角锥形,
故答案为:三角锥形;
③三个σ键和一个孤对电子对,所以中心原子采取sp3杂化,
故答案为:sp3;
④PH3分子中P-H键是不同非金属元素之间形成的极性共价键,该分子为三角锥型结构,分子结构不对称,为极性分子,
故答案为:有;极性;
⑤N、P属于同一主族元素,N的非金属性强于P,非金属性越强,氢化物越稳定,PH3与NH3的热稳定性:NH3 更强,
故答案为:NH3.
点评 本题考查物质结构、化学键、杂化方式、分子的空间构型等,综合性强,难度中等,注意PH3的电子式书写不能漏掉一对孤对电子对.


科目:高中化学 来源: 题型:实验题

| t/℃ | 700 | 800 | 830 | 1000 |
| K | 20 | 10 | 1.0 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原电池是利用两个电极之间金属性的不同,产生电势差,从而使电子的流动,产生电流.随着科学技术的不断发展,以原电池原料为基础,科学家们研制出了各式各样的化学电源,请应用原电池相关知识回答:
原电池是利用两个电极之间金属性的不同,产生电势差,从而使电子的流动,产生电流.随着科学技术的不断发展,以原电池原料为基础,科学家们研制出了各式各样的化学电源,请应用原电池相关知识回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质水解的最终产物都是α-氨基酸 | |
| B. | 臭氧可用于自来水的消毒,是由于臭氧具有强的氧化性 | |
| C. | 工业上生产氨气时可以用分离出氨气的方法提高转化率,是利用氨易液化的性质 | |
| D. | 氧化铝能与氢氧化钠溶液反应,又能与盐酸反应,是因为氧化铝是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
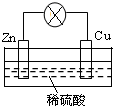
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
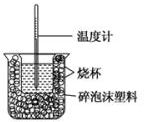 已知在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热.现利用如图装置进行中和热的测定,请回答下列问题:
已知在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热.现利用如图装置进行中和热的测定,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com