
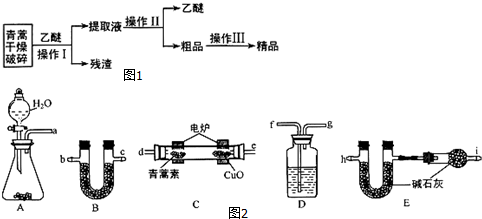
| 装置质量 | 实验前/g | 实验后/g |
| B | 22.6 | 42.4 |
| E(不含干燥管) | 80.2 | 146.2 |
分析 根据乙醚浸取法的流程可知,对青蒿进行干燥破碎,可以增大青蒿与乙醚的接触面积,提高青蒿素的浸取率,用乙醚对青蒿素进行浸取后,过滤,可得滤液和滤渣,提取液经过蒸馏后可得青蒿素的粗品,对粗品加95%的乙醇,浓缩、结晶、过滤可得精品;
(1)为提高青蒿素的浸取率,可以对青蒿进行干燥破碎,由此增大青蒿与乙醚的接触面积;
(2)操作Ⅰ为过滤操作,可结合该实验操作确定使用玻璃仪器;分离相互混溶的液体混合物可依据沸点差异,选择蒸馏操作进行分离;
(3)①为了能准确测量青蒿素燃烧生成的CO2和H2O,实验前应通入除去CO2和H2O的空气,排除装置内的空气,防止干扰实验.E和F一个吸收生成的H2O,一个吸收生成的CO2,应先吸水后再吸收CO2,所以E内装的CaCl2或P2O5,而F中为碱石灰,而在F后应再加入一个装置防止外界空气中CO2,和H2O进入的装置,据此答题;
②灼热的CuO可以将CO氧化为二氧化碳;
③装置D的作用是干燥进入C装置的氧气,结合盛放的是液体且能作干燥剂判断试剂的名称;
④根据生成的CO2和水的质量,结合原子守恒,判断青蒿素中氧元素的质量,再计算C、H、O的原子数目比,推测青蒿素的最简式;
(4)根据酯能溶于水,能在氢氧化钠溶液中水解并消耗氢氧化钠进行判断.
解答 解:根据乙醚浸取法的流程可知,对青蒿进行干燥破碎,可以增大青蒿与乙醚的接触面积,提高青蒿素的浸取率,用乙醚对青蒿素进行浸取后,过滤,可得滤液和滤渣,提取液经过蒸馏后可得青蒿素的粗品,对粗品加95%的乙醇,浓缩、结晶、过滤可得精品,
(1)根据乙醚浸取法的流程可知,对青蒿进行干燥破碎,可以增大青蒿与乙醚的接触面积,提高青蒿素的浸取率,
故答案为:增大青蒿与乙醚的接触面积,提高青蒿素的浸取率;
(2)根据上面的分析,操作I为过滤,需要的玻璃仪器主要有:烧杯、漏斗、玻璃棒,为加速过滤的进行,最好采用 抽滤或减压过滤的方法,操作Ⅱ的名称是蒸馏,
故答案为:漏斗、玻璃棒;抽滤或减压过滤;蒸馏;
(3)①为了能准确测量青蒿素燃烧生成的CO2和H2O,实验前应通入除去CO2和H2O的空气,排除装置内的空气,防止干扰实验.E和F一个吸收生成的H2O,一个吸收生成的CO2,应先吸水后再吸收CO2,所以E内装的CaCl2或P2O5,而F中为碱石灰,而在F后应再加入一个装置防止外界空气中CO2,和H2O进入的装置,即装置的连接顺序为afgdebchi,故答案为:afgdebchi;
②选用CuO可以将青蒿素不完全燃烧生成的CO氧化成CO2,则CuO的作用为使青蒿素充分氧化生成CO2和H2O,故答案为:使青蒿素充分氧化生成CO2和H2O;
③为了防止进入C装置的氧气中混有有水蒸气,可利用D装置中盛放的浓硫酸进行干燥,故答案为:浓硫酸;
④由数据可知 m(H2o)=42.4-22.6=19.8g,所以n(H2o)=1.1mol
m(co2)=146.2-80.2=66g,所以 n(co2)=1.5mol
所以青蒿素中氧原子的质量为m(o)=28.2-(2.2×1)-(1.5×12)=6g,所以n(o)=0.5mol,
N(C):N(H):N(o)=1.5:2.2:0.5=15:22:5,所以C15H22O5,
故答案为:C15H22O5
(4)由于酯能溶于水,能在氢氧化钠溶液中水解并消耗氢氧化钠结合题意可知,青蒿素中含有酯基,故选C.
点评 本题考查物质制备的有关实验设计、操作、评价以及有关计算等知识点,题目难度中等,明确实验目的、实验原理为解答关键,试题综合性强,侧重对学生实验能力的培养.


科目:高中化学 来源: 题型:选择题
| A. | 过滤操作中,漏斗的尖端应接触烧杯内壁 | |
| B. | 从滴瓶中取用试剂时,滴管的尖嘴可以接触试管内壁 | |
| C. | 滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁 | |
| D. | 向容量瓶转移液体时,导流用玻璃棒可以接触容量瓶内壁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 等二次污染物.
等二次污染物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E都是元素周期表中的前20号元素,原子序数依次增大,B、C、D同周期,A、D原子中某p能级均排有5个电子,E和其他元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.
A、B、C、D、E都是元素周期表中的前20号元素,原子序数依次增大,B、C、D同周期,A、D原子中某p能级均排有5个电子,E和其他元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
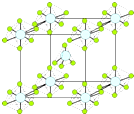 磷元素在生产和生活中有广泛的应用.
磷元素在生产和生活中有广泛的应用.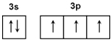 .
.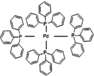 ):P原子以正四面体的形态围绕在钯原子中心上,钯原子的杂化轨道类型为sp3;判断该物质在水中溶解度并加以解释不易溶于水.水为极性分子,四(三苯基膦)钯分子为非极性分子,分子极性不相似,故不相溶.该物质可用于如图所示物质A(
):P原子以正四面体的形态围绕在钯原子中心上,钯原子的杂化轨道类型为sp3;判断该物质在水中溶解度并加以解释不易溶于水.水为极性分子,四(三苯基膦)钯分子为非极性分子,分子极性不相似,故不相溶.该物质可用于如图所示物质A(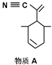 )的合成:物质A中碳原子杂化轨道类型为sp、sp2、sp3;一个A分子中手性碳原子数目为3.
)的合成:物质A中碳原子杂化轨道类型为sp、sp2、sp3;一个A分子中手性碳原子数目为3.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 )分子中有5n个σ键
)分子中有5n个σ键| 化学键 | Si-Si | O═O | Si-O |
| 键能(kJ•mol-1) | a | b | c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金 | B. | 硫 | C. | 铜 | D. | 铁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com