
Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e═Li2S+Fe ,有关该电池的下列中,正确的是
A. Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价
B. 该电池的电池反应式为:2Li + FeS = Li2S + Fe
C. 负极的电极反应式为Al-3e-=Al3+
D. 充电时,阴极发生的电极反应式为:Li2S + Fe -2e- = 2Li+ + FeS
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年江苏省高二下学期学业水平模拟化学试卷(解析版) 题型:选择题
下列化学用语表示正确的是
A. NaOH 的电子式: B. F-的结构示意图:
B. F-的结构示意图:
C. 乙酸的结构简式:C2H4O2 D. MgCl2的电离方程式:MgCl2=Mg2++Cl2-
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三第七次月考化学试卷(解析版) 题型:实验题
下图所示为常见气体制各、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。
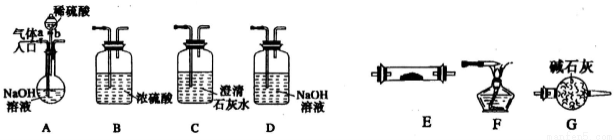
(1)若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为A→____→____→E→____→____(填代号)。能验证CO氧化产物的现象是_______________。
(2)若气俸入口改通空气,分液漏斗内改加浓氨水,圆底烧瓶内改加NaOH固体,E内放置铂铑合金网(做催化剂),按A→G→E→D装置顺序制取干燥的氨气并验证氨的某些性质。
①写出装置A中能产生氨气的两个原因:__________;___________________。
②实验中观察到E内有红棕色气体出现,证明氨气具有__________性。E中发生反应的化学方程式: __________、_______________。
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三上学期第二次模考化学试卷(解析版) 题型:实验题
硫酰氯(SO2Cl2)可用作有机化学的氯化剂,在药物和染料的制取中也有重要作用。某化学学习小组拟用干燥的氯气和二氧化硫在活性炭催化下制取硫酰氯。
SO2(g)+ Cl2(g) =SO2Cl2(l) △H = -97.3 kJ·mol-1。实验装置如图所示(部分夹持装置未画出):
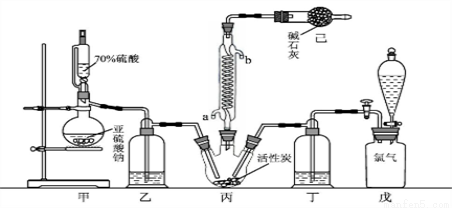
已知:硫酰氯通常条件下为无色液体,熔点-54.1℃,沸点69.1℃。在潮湿空气中“发烟”;100°C以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。 回答下列问题:
(1)盛放活性炭的仪器名称是___________,丙中冷凝水的入口是______(填“a”或“b”)。如何控制反应物比例相等_________________。
(2)戊装置上方分液漏斗中最好选用下列_______试剂。(填字母)
a. 蒸馏水 b.饱和食盐水 c. 浓氢氧化钠溶液 d. 6.0mol/L盐酸
(3)若缺少装置乙和丁(均盛放浓硫酸),潮湿氯气和二氧化硫发生反应化学方程式是_____。
(4)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯:2ClSO3H =SO2Cl2 + H2SO4,分离两种产物的方法是____________(填入正确选项前的字母)。
a.重结晶 b.过滤 c.蒸馏 d.萃取
(5)长期储存的硫酰氯会发黄,可能的原因是_______________(使用必要文字和相关方程式加以解释)。
(6)若反应中消耗的氯气体积为896mL(标准状况下),最后经过分离提纯得到4.05g纯净的硫酰氯,则硫酰氯的产率为________。为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有_____(填序号)。
①先通冷凝水,再通气
②控制气流速率,宜慢不宜快
③若丙装置发烫,可适当降温
④加热丙装置
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三上学期第二次模考化学试卷(解析版) 题型:选择题
标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度为p g/ml,质量分数为W,物质浓度为c mol/L,则下列关系中不正确的是
A. 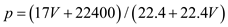 B.
B. 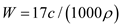
C. 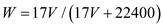 D. c=1000Vρ/(17V+22400)
D. c=1000Vρ/(17V+22400)
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三上学期第二次模考化学试卷(解析版) 题型:选择题
有关电解质溶液下列说法正确的是
A. 常温下同浓度的强酸、强碱等体积混合后由水电离出的c(H+)=10-7mol·L-1
B. 将AlCl3溶液、Na2SO3溶液蒸干并灼烧可以得到Al2O3、Na2SO3
C. 常温下0.1mol·L-1的Na2A溶液的pH=10,则该溶液中由水电离的c(OH-)=10-10mol·L-1
D. 常温下pH=2的盐酸和pH=12的氨水等体积混合后c(Cl-)+ c(H+)<c(NH4+)+ c(OH-)
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三3月选考化学试卷(解析版) 题型:实验题
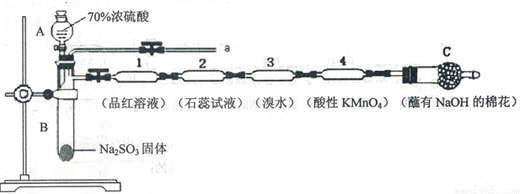
为了验证SO2的性质,某同学利用输液管设计了如下微型实验:
请回答:
(1)仪器A的名称是_________________。
(2)装置C中NaOH的作用是_________________。
(3)下列说法正确的是_________________。
A.装置l、3、4中溶液均褪色,可证明SO2具有漂白性
B.装置2中石蕊试液只变红不褪色,证明SO2是一种酸性氧化物
C.反应结束后,可由a导管向装置中加水,将气体赶出后再拆装置
D.在a导管处用向下排空气法收集SO2
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三3月选考化学试卷(解析版) 题型:选择题
下列说法正确的是
A. 容量瓶和分液漏斗使用前必须要检漏、干燥
B. 可以用酒精萃取溶解在水中的碘
C. 新制氯水应保存在棕色细口瓶中
D. 某溶液焰色反应呈黄色,说明溶液中含有Na+,不含K+
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆哈密地区第二中学高二上学期期末考试化学试卷(解析版) 题型:选择题
用物质的量都是0.1 mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中
c(CH3COO-)>c(Na+),对该混合溶液的下列判断正确的是
A. c(H+)>C(OH-)
B. c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1
C. c(CH3COOH)>c(CH3COO-)
D. c(CH3COO-)+c(OH-)=0.2 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com