
【题目】已知X、Y中含有相同的元素,Z、W中也含有相同的元素,根据反应X+H2O→Y+H2↑;Z+H2O→W+O2↑(方程式均未配平),可推断X、Y中及Z、W中相同元素的化合价的高低顺序为 ( )
A. X>Y,Z>W B. X<Y,Z<W
C. X>Y,Z<W D. X<Y,Z>W
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】(1)K2Cr2O7的水溶液中存在如下平衡:Cr2O72-(aq)+ H2O(l) ![]() 2CrO42-(aq)+ 2H+(aq),平衡常数表达式为__________;
2CrO42-(aq)+ 2H+(aq),平衡常数表达式为__________;
已知:在水溶液中K2Cr2O7为橙红色,K2CrO4为黄色。
往上述溶液中加入氢氧化钠溶液呈_______色,再加入过量硫酸溶液呈___________色;此实验现象,符合勒夏特列原理:如果改变维持化学平衡的条件(浓度、压强或温度),平衡就会向着_________这种改变的方向移动;
(2)在KMnO4与H2C2O4反应中,可通过测定_________________的时间来测定该反应的速率;
此反应开始反应缓慢,随后反应迅速加快,其原因是______(填字母)
A.KMnO4溶液中的H+起催化作用
B.生成的CO2逸出,使生成物浓度降低
C.反应中,生成的Mn2+起催化作用
D.在酸性条件下KMnO4的氧化性增强
(3)为探讨化学反应速率的影响因素,设计的实验方案如下表(已知 I2+2S2O32-===S4O62-+2I-,其中Na2S2O3溶液均足量)。
实验 序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
①淀粉溶液的作用是__________________________。
②表中Vx=_______mL,比较t1、t2、t3大小____________,
试推测该实验结论: ____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)已知拆开![]() 键、
键、![]() 键、
键、![]() 键分别需要吸收的能量为
键分别需要吸收的能量为![]() 、
、![]() 、
、![]() 。则由
。则由![]() 和
和![]() 反应生成1molHCl需要_______
反应生成1molHCl需要_______![]() 填“放出”或“吸收”
填“放出”或“吸收”![]() _________
_________![]() 的热量。
的热量。
![]() 可以在
可以在![]() 中安静地燃烧。甲、乙两图中,能表示该反应能量变化的是图_____
中安静地燃烧。甲、乙两图中,能表示该反应能量变化的是图_____![]() 填“甲”或“乙”
填“甲”或“乙”![]() 。
。
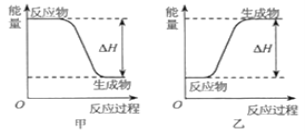
(3)将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应 ![]() 。2min后,测得D的浓度为
。2min后,测得D的浓度为![]() mol/L ,
mol/L ,![]() ,C的反应速率是
,C的反应速率是![]() mol/(L·min)。则:
mol/(L·min)。则:
![]() 的值是__________;
的值是__________;
![]() 的平均反应速率是____________;
的平均反应速率是____________;
![]() 在2min末的浓度是________________;
在2min末的浓度是________________;
④若此后各物质的量均不再变化,则证明此可逆反应达到了_______的程度。
A.反应彻底 ![]() 反应终止
反应终止 ![]() 化学平衡
化学平衡 ![]() 无法判断
无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnCO3可用于制备活性电极材料MnO2。以菱锰矿(含MnCO3、SiO2、FeCO3和少量Al2O3等)为原料制备碳酸锰粗产品的流程如下:

已知:①常温下,Ksp[Fe(OH)3]=8.0×10-38,Ksp[Al(OH)3]=4.0×10-34。
②氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.6、3.4;Mn2+开始沉淀的pH为8.1。
(1)“酸浸”过程中不能用浓盐酸替代硫酸,原因是_________________________________。
(2)用离子方程式表示“氧化”过程中加MnO2的目的:_______________________________。
(3)“调pH”时,向含有硫酸铁和硫酸铝的混合溶液中滴加氢氧化钠溶液至两种沉淀共存,当c(Fe3+)=1.0×10-5mol·L-1时,c(Al3+)=______________mol·L-1。
(4)①“沉锰”过程中,反应的离子方程式为_____________________。
②“沉锰”过程中沉锰速率与温度的关系如图所示。当温度高于60℃时,沉锰速率随着温度升高而减慢的原因可能是_____________________________。

(5)从滤液3中可分离出一种不含碳元素的氮肥,它的化学式为_____________________________。
(6)工业上,可以将碳酸锰制成硫酸锰,再用惰性电极电解酸性硫酸锰溶液来制备活性二氧化锰,电解时的阳极反应式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列叙述正确的是( )
A.煤的干馏、煤的液化和石油的分馏均属化学变化
B.液化石油气和天然气的主要成分都是甲烷
C.裂化汽油和直馏汽油都可以萃取溴水中的Br2
D.用浸泡过高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可到达水果保鲜的目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在容积为2 L的密闭容器中,A、B的物质的量随时间变化的曲线如图所示,请据图回答下列问题:
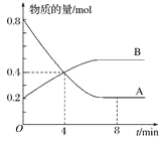
(1)该反应的化学方程式为_______________。
(2)在4 min末时,A、B的物质的量浓度c(A)________c(B),从0~4 min内A、B的物质的量浓度变化量Δc(A)________Δc(B)(以上填“>”、“<”或“=”)。
(3)反应开始至4 min时,A的平均反应速率为_______________________。
(4)4 min时,反应是否达到平衡状态?________(填“是”或“否”)。8 min时,υ(正)________(填“>”、“<”或“=”)υ(逆)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.利用植物油的加成反应可以制得人造黄油
B.75%的酒精可使蛋白质变性从而起到消毒作用
C.纤维素在人体内可水解成葡萄糖,供人体组织的营养需要
D.油脂能量最高的营养物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.放热反应在常温下一定很容易发生
C.反应是放热还是吸热,可根据反应物和生成物所具有的总能量的相对大小判断
D.吸热反应在常温下一定不能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将30mL 0.5molL-1 NaOH溶液加水稀释到500mL,稀释后的溶液中NaOH的物质的量浓度为
A. 0.3 molL-1 B. 0.05 molL-1 C. 0.03 molL-1 D. 0.02 molL-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com