
| A. | 氯化氢 | B. | 氢氧化钠 | C. | 酒精 | D. | 氯化钠 |
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:选择题
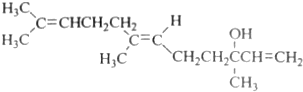
| A. | 橙花醇的分子式为C15H24O | |
| B. | 在浓硫酸催化下加热脱水,可以生成不止一种四烯烃 | |
| C. | 在一定条件下能发生取代、催化氧化、酯化、加聚反应 | |
| D. | 0.1mo1橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗0.3mo1Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 | 7.6 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 | 10.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 可能是甲烷和丁烷的混合物 | B. | 可能是甲烷和戊烷的混合物 | ||
| C. | 可能是丁烷和异丁烷的混合物 | D. | 可能是乙烷和丙烷的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Cl2和HCl | B. | N2和O2 | C. | SO2和CO2 | D. | CO2和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磷酸的摩尔质量与6.02×1023个硫酸分子的质量在数值上相等 | |
| B. | 6.02×1023个氮分子和6.02×l023个氢分子的质量比等于14:1 | |
| C. | 32g氧气所含的原子数目约为1.204×1024 | |
| D. | O2、SO2、SO3三者的质量比为2:4:5时,它们的物质的量之比为2:2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将0.2 mol/L的NH4Al(SO4)2溶液与0.3 mol/L的Ba(OH)2溶液等体积混合:2NH4++Al3++3SO42-+3Ba2++6OH-═Al(OH)3↓+AlO2-+3BaSO4↓+2H2O | |
| B. | 将含有等物质的量溶质的NaHCO3溶液和Ba(OH)2溶液混合:Ba2++HCO${\;}_{3}^{-}$+OH-═BaCO3↓+H2O | |
| C. | 在重铬酸钾溶液中,加酸后溶液变为黄色:Cr2O72-+H2O═2 CrO42-+2H+ | |
| D. | 过量氯水与FeI2溶液作用:2Fe2++2I-+2Cl2═2 Fe3++I2+4Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
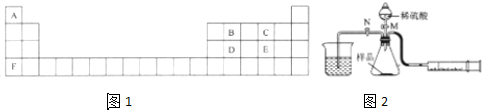
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制FeCl3溶液:将FeCl3固体溶于适量热的蒸馏水中,然后冷却至室温 | |
| B. | 制备银氨溶液:在1mL2%的氨水中逐滴加入2%的AgNO3溶液直至过量 | |
| C. | 提纯含有少量苯酚的苯:向含有少量苯酚的苯中加入适量浓溴水,过滤 | |
| D. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mL H2O,向另一支试管中加入2mL 5%H2O2和1mL FeCl3溶液,观察并比较实验现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com