
分析 (1)结合热化学方程式和盖斯定律计算所需热化学方程式;
(2)反应能够自发进行的判断依据为:△H-T△S<0,与熵变和焓变都有关系,据此解答.
解答 解:(1)①C(s )+O2 (g)=CO2(g)△H=-393.5KJ/mol
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283KJ/mol
盖斯定律计算得到:①-②得到C(s)与 O2(g)反应生成CO(g)的热化学方程式为:
C(s )+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5KJ/mol,
故答案为:C(s )+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5KJ/mol;
(2)反应能否自发进行与由熵变和焓变共同决定,
①△H-T△S=0,则反应达到平衡,故答案为:△H-T△S=0;
②△H-T△S<0,则反应能自发进行,故答案为:△H-T△S<0;
③△H-T△S>0,则反应不能自发进行,故答案为:△H-T△S>0;
点评 本题考查热化学方程式书写和盖斯定律的计算、化学反应方向的判据:△H-T△S<0反应自发进行,注意熵变与焓变都与反应能够自发进行有关,但都不是唯一因素,题目难度中等.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:解答题
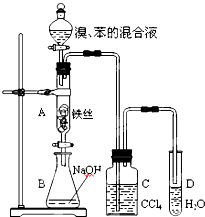 某化学课外小组用右图装置制取溴苯并探究该反应的类型.先向分液漏斗中加入苯和液溴,再将混合液滴入反应器A(A下端活塞关闭)中.
某化学课外小组用右图装置制取溴苯并探究该反应的类型.先向分液漏斗中加入苯和液溴,再将混合液滴入反应器A(A下端活塞关闭)中.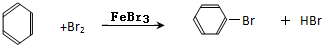 .
.| 向试管D中加入的试剂 | 能证明苯与液溴发生取代反应的现象 | |
| 方法一 | ||
| 方法二 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
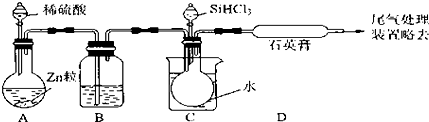
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| U | |||
| W | Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

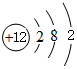 ,并写出元素b的单质在二氧化碳中燃烧的化学方程式:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C
,并写出元素b的单质在二氧化碳中燃烧的化学方程式:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C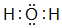 ,写出f元素单质与该氢化物反应的离子方程式:Cl2+H2O=H++Cl-+HClO.
,写出f元素单质与该氢化物反应的离子方程式:Cl2+H2O=H++Cl-+HClO.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com