
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量. | 若出现白色浑浊,则溶液中存在SO32-或 SO42-. |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体滴入1滴(或少量)品红,再滴入过量2mol/L盐酸,振荡 | 若品红褪色(或有气泡),, 则“吸收液”中存在 SO32-. |
| 步骤3:用试管取适量滤液,向其中(或小烧杯中)滴入过量的1mol/LBa(OH)2溶液[或滴入1滴(或少量)品红溶液,再滴入2-3滴(或过量)的2mol/L盐酸],振荡 | 若出现白色沉淀(或品红溶液褪色,或有气泡), 则“吸收液”中存在 HSO3-. |
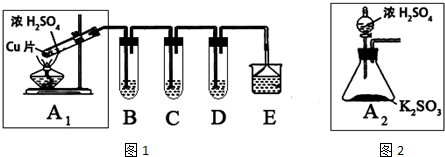
分析 (1)根据实验装置图可知,A1中用铜与浓硫酸在加热的条件下反应生成二氧化硫,据此书写反应的化学方程式;
(2)铜和浓硫酸加热反应生成二氧化硫气体,B、C、D分别用于检验SO2的还原性、氧化性和漂白性.其中C、D分别为硫化氢和品红的水溶液,检验二氧化硫的氧化性和漂白性;二氧化硫具有还原性,和碘水或溴水或酸性高锰酸钾溶液反应;
(3)依据装置图对比分析不同,总结优点;
(4)依据SO32-和HSO3-离子的性质和检验方法设计实验进行检验设计;结合题干信息和条件,取少量于小烧杯中加入过量氯化钡反应生成沉淀为亚硫酸钡或硫酸钡沉淀;取沉淀加入酸的生成二氧化硫,通过检验二氧化硫的存在方法验证亚硫酸根离子的存在;取滤液依据亚硫酸氢根离子和酸反应可以生成二氧化硫,检验二氧化硫完成实验设计,或通过亚硫酸氢根离子和氢氧化钡反应生成沉淀分析判断;
解答 解:(1)根据实验装置图可知,A1中用铜与浓硫酸在加热的条件下反应生成二氧化硫,反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)依据装置图可知,铜和浓硫酸加热反应生成二氧化硫气体,B、C、D分别用于检验SO2的还原性、氧化性和漂白性.其中C、D分别为硫化氢和品红的水溶液,检验二氧化硫的氧化性和漂白性;二氧化硫具有还原性,和碘水或溴水或酸性高锰酸钾溶液反应,所以B为碘水或溴水或酸性高锰酸钾溶液,
故答案为:碘水或溴水或酸性高锰酸钾溶液;
(3)装置图分析可知,A2的制取装置来代替A1装置,可以不需要加热,用分液漏斗加入硫酸可以控制反应速率,反应装置安全;
故答案为:①不用加热,安全性能高.②易于控制反应进行,反应更充分.(任写一个)
(4)依据SO32-和HSO3-离子的性质和检验方法设计实验进行检验设计;结合题干信息和条件,取少量于小烧杯中加入过量氯化钡反应生成沉淀为亚硫酸钡或硫酸钡沉淀;取沉淀加入酸的生成二氧化硫,通过检验二氧化硫的存在方法验证亚硫酸根离子的存在;取滤液依据亚硫酸氢根离子和酸反应可以生成二氧化硫,检验二氧化硫完成实验设计,或通过亚硫酸氢根离子和氢氧化钡反应生成沉淀分析判断;实验设计方法和步骤为:
| 实验操作 | 预期现象与结论 |
| 步骤2:滴入1滴(或少量)品红,再滴入过量2mol/L盐酸,振荡 | 若品红褪色(或有气泡),则“吸收液”中存在 SO32-. |
| 步骤3:用试管取适量滤液,向其中(或小烧杯中)滴入过量的1mol/LBa(OH)2溶液[或滴入1滴(或少量)品红溶液,再滴入2-3滴(或过量)的2mol/L盐酸],振荡. | 若出现白色沉淀(或品红溶液褪色,或有气泡),则“吸收液”中存在 HSO3-. |
| 实验操作 | 预期现象与结论 |
| 步骤2:滴入1滴(或少量)品红,再滴入过量2mol/L盐酸,振荡 | 若品红褪色(或有气泡) |
| 步骤3:用试管取适量滤液,向其中(或小烧杯中)滴入过量的1mol/LBa(OH)2溶液[或滴入1滴(或少量)品红溶液,再滴入2-3滴(或过量)的2mol/L盐酸],振荡. | 若出现白色沉淀(或品红溶液褪色,或有气泡), |
点评 本题考查了二氧化硫性质的实验验证方法和实验设计分析步骤,掌握实验基础和离子性质、离子检验方法,正确选择试剂,描述反应现象,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 12.8g | B. | 9.6g | C. | 6.4g | D. | 3.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.02 mol | B. | 0.01 mol | C. | 0.04 mol | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
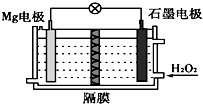
| A. | Mg 电极是该电池的正极 | B. | H2O2 在石墨电极上发生氧化反应 | ||
| C. | 石墨电极附近溶液的pH 增大 | D. | 溶液中Cl-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | A2+3B2?2AB3 | B. | 2AB2+B2?2AB3 | C. | 2A2 B+5B2═4AB3 | D. | 2AB2+B2═2AB |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
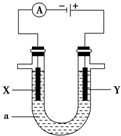 电解原理在化学工业中有着广泛的应用.现将设计的原电池通过导线与下图中电解池相连,其中,a为电解质溶液,X和Y是两块电极板,则:
电解原理在化学工业中有着广泛的应用.现将设计的原电池通过导线与下图中电解池相连,其中,a为电解质溶液,X和Y是两块电极板,则:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | F2、Cl2、Br2、I2的氧化性逐渐减弱 | |
| B. | HF、HCl、HBr、HI的热稳定性逐渐减弱 | |
| C. | F-、Cl-、Br-、I-的还原性逐渐增强 | |
| D. | 卤素单质按F2、Cl2、Br2、I2的顺序颜色变浅,密度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
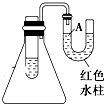 如图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应.将镁片加入小试管内,然后注入足量的盐酸,请根据要求完成下列问题:
如图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应.将镁片加入小试管内,然后注入足量的盐酸,请根据要求完成下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com