
| A、在酸性溶液中:Ba2+、K+、SO42-、Cl- |
| B、含有大量Al3+的溶液中:K+、Na+、NH4+、SO42- |
| C、使甲基橙变黄的溶液中:Na+、I-、CO32-、OH- |
| D、无色溶液中:K+、Cl-、Cr2O72-、HCO3- |


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
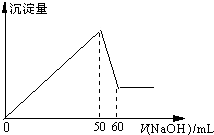 铝是应用最广泛的金属之一,铝的化合物在生产和生活中也有许多用途.
铝是应用最广泛的金属之一,铝的化合物在生产和生活中也有许多用途.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、非金属单质燃烧时火焰均为无色 |
| B、所有金属及其化合物灼烧时火焰均有颜色 |
| C、焰色反应均应透过蓝色钴玻璃观察 |
| D、NaCl与Na2CO3灼烧时火焰颜色相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.24 L |
| B、3.92 L |
| C、3.36 L |
| D、2.8 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、烹饪时产生的油烟 |
| B、二氧化碳含量过高造成的温室效应 |
| C、石材释放出的放射性有害气体 |
| D、劣质黏合剂释放出的甲醛等有害物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑤ | B、②③④ |
| C、①②③⑤ | D、全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com