
| A. | c(CH3COO-)>c(Ba2+)>c(OH-)>c(H+) | B. | c(H+)+c(Ba2+)=c(CH3COO-)+c(OH-) | ||
| C. | c(OH-)═c(H+)+c(CH3COO-) | D. | 2c(Ba2+)=c(CH3COO-)+c(CH3COOH) |
分析 A.CH3COO-离子水解程度较小,水解后溶液呈碱性,c(CH3COO-)>c(Ba2+);
B.从溶液的电中性角度考虑;
C.根据溶液电中性和物料守恒分析;
D.根据溶液中的物料守恒分析.
解答 解:A.CH3COO-离子水解程度较小,水解后溶液呈碱性,由(CH3COO)2Ba可知,则有c(CH3COO-)>c(Ba2+),c(OH-)>c(H+),正确的顺序应为,c(CH3COO-)>c(Ba2+)>c(OH-)>c(H+),故A正确;
B.溶液呈电中性,溶液中阳离子所带电荷等于阴离子所带电荷,则c(H+)+2c(Ba2+)=c(CH3COO-)+c(OH-),故B错误;
C.根据溶液电中性可知:c(H+)+2c(Ba2+)=c(OH-)+c(CH3COO-),根据物料守恒可知,c(CH3COOH)+c(CH3COO-)=2c(Ba2+),则有c(H+)+c(CH3COOH)+c(CH3COO-)=c(OH-)+c(CH3COO-),即c(H+)=c(OH-)-c(CH3COOH),故C正确;
D.由(CH3COO)2Ba,根据物料守恒可知:c(CH3COOH)+c(CH3COO-)=2c(Ba2+),故D正确;
故选B.
点评 本题考查溶液中离子浓度大小计较,题目难度中等,做题时注意从电荷守恒、物料守恒的角度着手分析,试题培养了学生的分析能力及灵活应用.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应(1)和(2)均为氧化还原反应 | |
| B. | 反应(1)的氧化剂是O2,还原剂是FeO•Cr2O3 | |
| C. | 高温下,O2的氧化性大于Fe2O3小于Na2CrO4 | |
| D. | 生成1mol的Na2Cr2O7时共转移5mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4、C4H6 | B. | C2H2、C4H8 | C. | C3H4、C4H8 | D. | C3H4、C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某试样焰色反应呈黄色,则试样中肯定不含有K+ | |
| B. | 过滤操作时,为了加快过滤可以用玻璃棒搅拌漏斗的液体 | |
| C. | 蒸馏装置中,温度计水银球的位置应该在蒸馏烧瓶的支管口附近 | |
| D. | 粗盐的提纯实验中,滤液在坩埚中加热蒸发结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
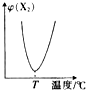
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
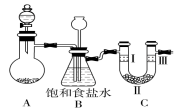 某学习小组围绕氯气设计了一系列实验.
某学习小组围绕氯气设计了一系列实验.| A | B | C | D | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子方程式 | 评价 |
| A | 将2molC l2通入到含1mol FeI2的溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、 I-均氧化 |
| B | Ba(HCO3)2溶液与足量的NaOH溶液反应:B a2++HCO3-+OH-=B aCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
| C | 1mol•L-1的Na[Al(OH)4]溶液和2.5mol•L-1的HCl溶液等体积互相均匀混合:2[Al(OH)4]-+5H+=A l3++Al(OH)3↓+5H2O | 正确;[Al(OH)4]-与Al(OH)3消耗的H+的物质的量之比为2:3 |
| D | 过量SO2通入到NaClO溶液中:SO2+H2O+ClO-=HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com