
| 0.6mol |
| 3 |


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
| A、若使溶液恢复到电解前的浓度可以向溶液中加20(10-b-10-a)g CuO |
| B、b<a<7 |
| C、阳极电极反应:4OH--4e-═2O2↑+4H+ |
| D、整个过程中是阳极产生氧气,阴极析出铜单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
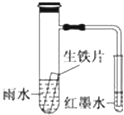 双鸭山一中某化学兴趣小组研究酸雨对生铁腐蚀情况的实验如下:图示小试管内为红色的墨水,具支试管中为pH=4.5放置一段时间的雨水和生铁.实验观察到:初期导管内液面下降,后来导管内液面回升,略高于小试管内液面.下列说法正确的是( )
双鸭山一中某化学兴趣小组研究酸雨对生铁腐蚀情况的实验如下:图示小试管内为红色的墨水,具支试管中为pH=4.5放置一段时间的雨水和生铁.实验观察到:初期导管内液面下降,后来导管内液面回升,略高于小试管内液面.下列说法正确的是( )| A、生铁片中的碳是原电池的负极,发生还原反应 |
| B、雨水酸性较强,生铁片始终发生析氢腐蚀 |
| C、墨水回升时,碳电极反应式为O2+2H2O+4e-═4OH- |
| D、具支试管中溶液酸性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
| A、该反应的△H>0 |
| B、加压、增大H2浓度和加入催化剂都能提高CO的转化率 |
| C、工业上采用5×103kPa和250℃的条件,其原因是原料气的转化率高 |
| D、t℃时,向1 L密闭容器中投入0.1 mol CO和0.2 mol H2,平衡时CO转化率为50%,则该温度时反应的平衡常数的数值为100 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子序数由大到小的顺序为Z<Y<X |
| B、Y元素最高价氧化物对应水化物的化学式可表示为H3YO4 |
| C、3种元素的气态氢化物中Z的气态氢化物最稳定 |
| D、原子半径由大到小的顺序为Z>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:l | B、1:2 |
| C、1:3 | D、1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定条件下,2molSO2和1molO2混合在密闭容器中充分反应后容器中的分子数大于2NA |
B、256g S8分子中含S-S键为7NA个  |
| C、由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 |
| D、1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
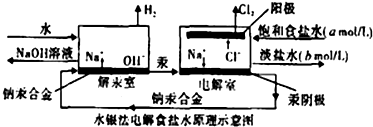 水银法电解食盐水是氯碱工业发展进程中的重要里程碑,以制得碱液纯度高、质量好而著称,其生产原理示意图如图.下列说法正确的是( )
水银法电解食盐水是氯碱工业发展进程中的重要里程碑,以制得碱液纯度高、质量好而著称,其生产原理示意图如图.下列说法正确的是( )| A、钠汞合金中钠的化合价为+1价 |
| B、电解室中产生氯气的电极为阳极,产生氢气的电极为阴极 |
| C、当阳极产生3.36 m3(标准状况)Cl2时,解汞室中生成NaOH的质量为24kg |
| D、目前氯碱生产采用离子膜法取代了水银法,其主要原因是汞有毒性,对环境有污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
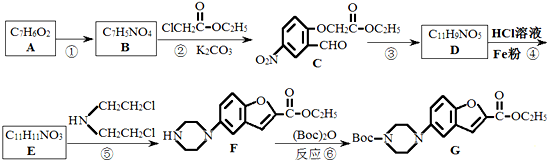
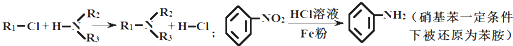
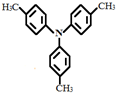 ,请设计合成路线(无机试剂及溶剂任选).
,请设计合成路线(无机试剂及溶剂任选).| O2 |
| 催化剂 |
| CH3CH2OH |
| 浓H2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com