
 Ņ»ÅµŹéŅµŹī¼Ł×÷ŅµæģĄÖ¼ŁĘŚŌĘÄĻĆĄŹõ³ö°ęÉēĻµĮŠ“š°ø
Ņ»ÅµŹéŅµŹī¼Ł×÷ŅµæģĄÖ¼ŁĘŚŌĘÄĻĆĄŹõ³ö°ęÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®Į½ÖÖ²»Ķ¬µÄŌŖĖŲ | B£®Ņ»ÖÖ·Ö×ÓÓėŅ»ÖÖŌ×Ó |
| C£®Ņ»ÖÖµ„ÖŹÓėŅ»ÖÖ»ÆŗĻĪļ | D£®Į½ÖÖ²»Ķ¬µÄ·Ö×Ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®Č«²æ | B£®¢Ś¢Ū¢Ü¢Ż | C£®Ö»ÓŠ¢Ś¢Ū¢Ü | D£®Ö»ÓŠ¢Ū¢Ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®MnO2ŗĶÅØŃĪĖį·“Ó¦ | B£®KC1O3ŗĶÅØŃĪĖį·“Ó¦ |
| C£®KMnO4ŗĶÅØŃĪĖį·“Ó¦ | D£®K2Cr2O7ŗĶÅØŃĪĖį·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ĮņÄÜŠĪ³É·Ö×Ó¾§Ģå | B£®¶žŃõ»Æ¹čµÄ·Ö×ÓŹ½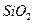 |
C£®“ĪĀČĖįµÄµē×ÓŹ½ 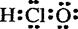 | D£®ÄĘĄė×ӵĽį¹¹Ź¾ŅāĶ¼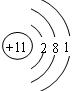 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 H2O2£«NaCl
H2O2£«NaCl  Ag£«O2”ü£«H2O
Ag£«O2”ü£«H2O H2O£«O2”ü
H2O£«O2”ü  K2CrO4£«K2SO4£«H2O
K2CrO4£«K2SO4£«H2O| A£®¶¼ŹĒŃõ»Æ»¹Ō·“Ó¦ | B£®·“Ó¦¢ÜÖŠ»¹ŌŠŌ:H2O > Cr2£ØSO4£©3 |
| C£®·¢Éś»¹Ō·“Ó¦µÄŌŖĖŲĻąĶ¬ | D£®H2O2¼ČÓŠŃõ»ÆŠŌ£¬ÓÖÓŠ»¹ŌŠŌ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®°¢·ü¼ÓµĀĀŽ³£Źż£ŗNA£¬mol | B£®Ä¦¶ūÖŹĮæ£ŗM £¬g”¤mol-1 |
| C£®ĘųĢåĦ¶ūĢå»ż£ŗVm £¬mol”¤L-1 | D£®ĪļÖŹµÄĮæÅضČ:£ŗC £¬L”¤mo L - 1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®Čō»ģŗĻŗóČÜŅŗpH=7,Ōņc(NH4+)=c(Cl-) |
B£®Čōa="2b," Ōņc(Cl-)>c(NH4+)>c(NH3”¤H 2O)>c(OH-)>c(H+) 2O)>c(OH-)>c(H+) |
| C£®Čōb=2a,Ōņc(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D£®Čō»ģŗĻŗóČÜŅŗĀś×ćc(H+)=c(OH-)+c(NH3”¤H2O)£¬ŌņæÉĶĘ³öa=b |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com