
(14分)某化工厂以软锰矿、闪锌矿(除主要成分为MnO2、ZnS外还含有少量的FeS、CuS、Al2O3等物质)为原料制取Zn和MnO2。
(1)在一定条件下,将这两种矿粉在硫酸溶液中相互作用,配平如下的化学方程式:
MnO2 + FeS + H2SO4 MnSO4 + Fe2(SO4)3 + S + H2O
MnSO4 + Fe2(SO4)3 + S + H2O
(2)将所得含有Mn2+、Fe3+、Cu2+、Al3+、Zn2+的酸性溶液按以下的工业流程进行操作处理得溶液(IV),电解溶液(IV)即得MnO2和Zn。

a.操作①中加Zn粉后发生反应的离子方程式为 。
b.操作②中加入适量X的作用是什么 ;X的首选物的化学式是 。
c.操作③中所加碳酸盐的化学式是 。
(3)为了从上述流程中产生的Fe(OH)3、Al(OH)3沉淀混合物中回收Al(OH)3,工厂设计了如下的有关流程图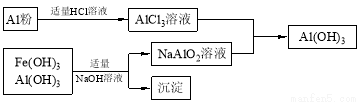
a.AlCl3溶液和NaAlO2溶液反应生成AI(OH)3的离子方程式为 ,若总共得到n molAl(OH)3,则消耗的NaOH和HCl的理论量(mol)分别为 、 。
b.若使用下列流程回收处理,请比较两个流程消耗酸碱的用量?

(1) 3 MnO2 + 2 FeS + 6 H2SO4== 3 MnSO4 + 1 Fe2(SO4)3 + 2 S + 6 H2O (2分)
(2)a.Zn + 2Fe3+==Zn2+ + 2Fe2+、Zn + Cu2+==Zn2+ + Cu (2分)
b.将Fe2+氧化成Fe3+ MnO2(2分)
c.MnCO3或ZnCO3 或MnCO3和ZnCO3(2分)
(3)a.Al3+ + 3AlO2-+ 6H2O==4Al(OH)3↓ (2分) 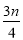
 (2分)
(2分)
b.如按下流程,则得到同样n molAl(OH)3,消耗的NaOH、HCl的理论量分别为n mol,大于前流程的消耗量,相对而言,前流程更符合节约的原则(2分)
【解析】
试题分析:(1)在一定条件下,将这两种矿粉在硫酸溶液中相互作用,根据原子守恒、电子守恒可得配平的化学方程式:3MnO2 + 2FeS +6H2SO4==3MnSO4 + Fe2(SO4)3 +2S + 6H2O;a.操作①向该溶液中加入Zn粉后,溶液中的Fe3+、Cu2+会与Zn发生氧化还原反应,发生反应的离子方程式为Zn + 2Fe3+==Zn2+ + 2Fe2+、Zn + Cu2+==Zn2+ + Cu;根据图示可知在酸性溶液Ⅱ中含有Fe2+、Al3+等,要将它们反应转化为Al(OH)3、Fe(OH)3沉淀,应该先加入氧化剂,将溶液中的Fe2+氧化为Fe3+;为了不引入新的杂质离子,加入的氧化剂可以是MnO2;c.操作③中所加碳酸盐就是调整溶液的酸碱性的,根据除杂的原则,该物质应该是的化学式是MnCO3或ZnCO3;(3)a.AlCl3溶液和NaAlO2溶液混合发生盐的双水解反应生成AI(OH)3,该反应的离子方程式为Al3+ + 3AlO2-+ 6H2O==4Al(OH)3↓;由于n(Al3+):n(AlO2-)=1:3,所以若总共得到n molAl(OH)3,则需要消耗AlCl3的物质的量是n/4mol,消耗NaAlO2的物质的量是3n/4mol,根据元素守恒可知n(NaOH)=n(NaAlO2)= 3n/4mol,n(HCl)=3n(AlCl3)= 3n/4mol,b.若使用下列流程回收处理,得到同样n molAl(OH)3,消耗的NaOH、HCl的理论量分别为n mol,大于前一个流程消耗酸碱的用量,因此相对而言,前流程更符合节约的原则。
考点:考查氧化还原反应离子方程式的书写、物质的选择及作用、关于化学方程式的计算、化学实验方案的设计及评价的知识。


科目:高中化学 来源:2014-2015学年宁夏银川市高三上学期期末理综化学试卷(解析版) 题型:选择题
下列各组离子能在指定溶液中大量共存的是
①无色溶液中:Al3+、Cl-、Na+、HCO3-、SO42-
②pH=11的溶液中:Na+、AlO2-、NO3-、S2-、SO32-
③加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42-
④使pH试纸呈红色的溶液中:Fe3+、MnO4-、Na+、SO42-
⑤酸性溶液中:Fe2+、Al3+、NO3-、I-
A.①②④ B.①⑤ C.②③④ D.①②③
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南京市、盐城市高三一模化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,22.4L己烷中含己烷分子数目为NA
B.28g由乙烯和丙烯组成的混合气体中含碳碳双键数目为NA
C.71gNa2SO4固体中含钠离子数目为NA
D.25g质量分数68%的H2O2水溶液中含氧原子数目为NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省连云港等四市高三一模化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差
B.常温下,MgO(s)+C(s)=Mg(s)+CO(g)不能自发进行,则其△H>0
C.在NaCl和KBr的混合溶液中滴加AgNO3溶液,一定先产生淡黄色沉淀
D.加热0.1 mol·L-1Al2(SO4)3溶液,水解程度增大、溶液的酸性增强
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省连云港等四市高三一模化学试卷(解析版) 题型:选择题
下列物质性质与应用对应关系正确的是
A.二氧化锰具有还原性,可用于实验室制备氯气
B.Na2O2能与水或二氧化碳反应生成氧气,可用作供氧剂
C.碳酸氢钠能与碱反应,可用作食品的膨松剂
D.Na2SO4浓溶液能使蛋白质发生盐析,可用于杀菌、消毒
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏常州市高三第一次调研试卷化学试卷(解析版) 题型:选择题
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g) + xB(g) 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
容器 | 甲 | 乙 | 丙 |
容积 | 0.5L | 0.5L | 1.0L |
温度/℃ | T1 | T2 | T2 |
反应物 起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |

下列说法正确的是
A.10min内甲容器中反应的平均速率v(A)=0.025mol/(L·min)
B.由图可知:T1<T2,且该反应为放热反应
C.x=1,若平衡时保持温度不变,改变容器体积平衡不移动
D.T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25%
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏常州市高三第一次调研试卷化学试卷(解析版) 题型:选择题
下图是实验室制取无水氯化镁的装置图,下列有关表述正确的是
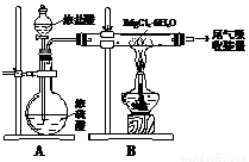
A.装置A中圆底烧瓶中可以换成固体MnO2
B.如果直接加热MgCl2?6H2O不能得到无水氯化镁,将得到Mg(OH)Cl或MgO
C.尾气吸收可以用浓硫酸作为吸收剂进行吸收
D.金属镁在空气中燃烧,剧烈反应生成氧化镁,如果金属镁燃烧发生火灾,要立即用二氧化碳灭火器进行灭火
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省肇庆市高三第一学期期末考试化学试卷(解析版) 题型:选择题
下列各离子组能够大量共存的是
A.H+ 、NH4+、I-、NO3— B.Na+、 Ca2+、 ClO-、HCO3—
C.K+、Mg2+、CO32—、SO42— D.Hg2+、H+、Cl-、S2-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市昌平区高二上学期期末考试化学试卷(解析版) 题型:选择题
下列事实不能用有机物分子内基团间的相互作用解释的是
A.乙烯能发生加成反应而乙烷不能
B.苯酚能跟NaOH溶液反应而乙醇不能
C.甲苯能使KMnO4酸性溶液褪色而苯不能
D.苯在50℃~ 60℃时发生硝化反应而甲苯在30℃时即可
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com