
在无色酸性溶液中能大量共存的离子组是( )
A. NH4+、Fe3+、SO42﹣、Cl﹣ B. Ba2+、K+、OH﹣、NO3﹣
C. Al3+、Cu2+、SO42﹣、Cl﹣ D. Na+、Ca2+、Cl﹣、NO3﹣
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
为测定某有机化合物X的结构,进行如下实验:
(1)取一定量有机物X在氧气中完全燃烧,测得生成8.8g CO2和3.6g H2O,消耗标准状况下的氧气5.6L,则X中含有 种元素.
(2)用质谱仪测得A的相对分子质量为44,则X的分子式为 .
(3)根据价键理论,试写出X可能的结构简式(不考虑含有 结构的物质) .
结构的物质) .
(4)X的核磁共振氢谱中出现两个不同位置的峰,则X与氢气反应的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
将30mL 0.5mol/L NaOH 溶液加水稀释到500mL,稀释后溶液中NaOH的物质的量浓度为()
A. 0.3 mol/L B. 0.03 mol/L C. 0.05 mol/L D. 0.04 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+.为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁晶体和金属铜.请根据如下回收流程图,回答有关问题:
(1)加入①为 ,加入②为 (要考虑用量).
(2)操作②的名称为 .
(3)母液中含有的离子有(填离子符号): .
(4)为了得到纯净的FeSO4•7H2O晶体,操作③在蒸发、冷却结晶后还要洗涤FeSO4•7H2O晶体,洗涤FeSO4•7H2O晶体的方法是:
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子,能在溶液中大量共存的是( )
A. Na+、Mg2+、OH﹣ B. H+、SO42﹣、CO32﹣
C. Cu2+、SO42﹣、Cl﹣ D. Ca2+、Cl﹣、CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有Cl﹣、SO42﹣、NO3﹣、CO32﹣等阴离子.
(1)当溶液中有大量H+存在时,则上述阴离子在溶液中不可能大量存在的是 .
当溶液中有大量Ba2+存在时,则上述阴离子在溶液中不可能大量存在的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
某兴趣小组设计如下微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生:一段时间后,断开K1,闭合K2,发现电流表A指针偏转.下列有关描述正确的是()
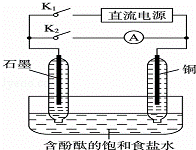
A. 断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl﹣═Cl2↑+H2↑
B. 断开K1,闭合K2时,石墨电极作正极
C. 断开K2,闭合K1时,石墨电极附近溶液变红
D. 断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e﹣═2Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
某待测溶液(阳离子为Na+)中可能含有SO42﹣、SO32﹣、NO3﹣、C1﹣、Br﹣、S2﹣、CO32﹣、HCO3﹣中的一种或多种,进行如图所示的实验,每次实验所加试剂均过量,回答以下问题: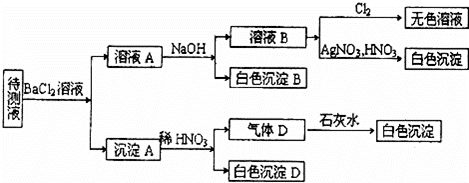
(1)待测液中是否含有SO42﹣、SO32﹣: .
(2)沉淀B的化学式为 ;生成沉淀B的离子方程式为 .
(3)根据以上实验,待测液中肯定没有的离子是 ;肯定存在的离子还有 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com