
| A. | 加入AgNO3溶液和稀盐酸,生成白色沉淀,可确定有Cl-存在 | |
| B. | 用洁净铂丝蘸取该溶液在火焰上灼烧,产生黄色火焰,则原溶液中一定含有钠盐 | |
| C. | 加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定含有CO32- | |
| D. | 加入KSCN溶液,溶液不变红,再加氯水后溶液显红色,则原溶液一定含Fe2+ |
分析 A.加入盐酸引入氯离子;
B.焰色反应为元素的性质,只能说明含有钠元素;
C.可能含有CO32-、SO32-、HCO3-、HSO3-等离子;
D.滴加氯水后溶液显红色,说明生成Fe3+.
解答 解:A.加入盐酸引入氯离子,应加入硝酸酸化,故A错误;
B.焰色反应为元素的性质,只能说明含有钠元素,不一定为钠盐,也可能为NaOH等,故B错误;
C.生成气体可能为二氧化碳、二氧化硫,可能含有CO32-、SO32-、HCO3-、HSO3-等离子,故C错误;
D.滴加氯水后溶液显红色,说明生成Fe3+,而滴加KSCN 溶液,溶液不变色,说明含有Fe2+,氯气氧化Fe2+生成Fe3+,故D正确.
故选D.
点评 本题考查物质的检验和鉴别,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握物质的性质的异同,注意把握常见离子的鉴别方法,难度不大.


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:解答题
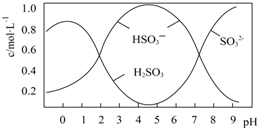 葡萄酒常用Na2S2O5做抗氧化剂.
葡萄酒常用Na2S2O5做抗氧化剂.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 5 | 15 | 25 | 35 |
| N(M)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
| A. | 35s时,N的浓度为0.80mol•L-1 | |
| B. | 达到平衡时,M的转化率为80% | |
| C. | 相同温度下若起始时向容器中充入1.0molP,则达到平衡时P的浓度为0.1mol•L-1 | |
| D. | 相同温度下,起始时向容器中充入0.20molM、0.20molN和1.0molP,反应达到平衡前v(逆)<v(正) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶剂质量不变 | B. | 溶质质量变大 | C. | 溶液的浓度不变 | D. | 溶解度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
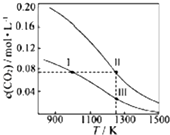 在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )| A. | 反应CO2(g)+C(s)?2CO(g)的△S>0、△H<0 | |
| B. | 体系的总压强P总:P总(状态Ⅱ)<2P总(状态Ⅰ) | |
| C. | 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) | |
| D. | 逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作及现象 | 溶液 |
| A | 通入二氧化碳,溶液变浑浊 | 饱和碳酸钠溶液 |
| B | 通入二氧化碳,溶液变浑浊,继续通二氧化碳至过量,浑浊消失 | 硅酸钠溶液 |
| C | 通入二氧化碳,溶液变浑浊,继续通二氧化碳至过量,浑浊消失,再加入足量氢氧化钠溶液,又变浑浊 | 澄清石灰水 |
| D | 通入二氧化碳,溶液变浑浊,再加入品红溶液,红色褪色 | 次氯酸钙溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
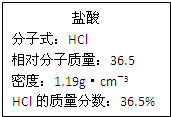 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锥形瓶用蒸馏水洗涤后,再用氢氧化钠溶液润洗 | |
| B. | 滴定管用蒸馏水洗涤后,即装入标准盐酸进行滴定 | |
| C. | 滴定时,边摇动锥形瓶边观察瓶中溶液的颜色变化 | |
| D. | 当滴定至溶液由黄色变为橙色时,即为滴定终点 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com