
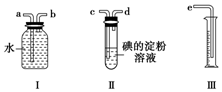
 已知SO2+I2+2H2O═H2SO4+2HI,某化学兴趣小组选用下列实验装置,测定工业原料气(含SO2、N2、O2)中的SO2的含量.
已知SO2+I2+2H2O═H2SO4+2HI,某化学兴趣小组选用下列实验装置,测定工业原料气(含SO2、N2、O2)中的SO2的含量.分析 (1)原料气通过碘的淀粉溶液,碘能氧化H2SO3,生成H2SO4 ,吸收二氧化硫气体,通过装置ⅠⅢ排水量气测定仪器和氮气的体积;
(2)装置Ⅱ是吸收二氧化硫气体,碘的淀粉溶液是蓝色,当蓝色褪去,说明碘单质全部反应,应停止通气;
(3)依据碘单质氧化二氧化硫的化学方程式计算二氧化硫气体体积,得到SO2的体积分数.
解答 解:(1)原料气通过碘的淀粉溶液,碘能氧化H2SO3,生成H2SO4 ,吸收二氧化硫气体,通过装置ⅠⅢ排水量气测定仪器和氮气的体积,连接装置接口顺序为:c→d→b→a→e;
故答案为:c→d→b→a→e;
(2)装置Ⅱ是吸收二氧化硫气体,碘的淀粉溶液是蓝色,当蓝色褪去,反应的离子方程式为:说明碘单质全部反应,应停止通气,否则二氧化硫吸收不完全,造成误差;
故答案为:蓝色恰好变成无色;
故答案为:SO2+I2+2H2O═4H++SO42-+2I-;蓝色褪去;
(3)反应方程式I2+SO2+2H2O=2I-+SO42-+4H+
由条件知n(SO2)=n(I2)=0.05 mol/L×0.02 L=0.001 mol,即22.4 mL,
所以工业原料气总体积为 297.6 mL+22.4 mL=320 mL,
SO2的体积分数=$\frac{22.4ml}{320ml}$×100%=7%,
故答案为:7%.
点评 本题考查了二氧化硫性质分析,处理方法和计算应用,注意实验测定过程的分析判断,掌握基础是关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 1L 1mol/L的HCl溶液中所含氯化氢分子数为NA | |
| B. | 体积为6L 的 O2,其质量不可能为8 g | |
| C. | 1 mol FeCl3完全转化为Fe(OH)3胶体后生成NA个胶体粒子 | |
| D. | 1mol 过氧化钠中阴离子所带电荷数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取一定量固体,溶解,向溶液中加入适量CaO粉末,充分反应后观察到有白色沉淀生成,说明原固体中一定含有Na2CO3 | |
| B. | 取一定量固体,溶解,向溶液中通入的CO2,观察到有晶体析出,说明原固体中一定含有Na2CO3 | |
| C. | 取一定量固体,加热,若产生的气体能使澄清石灰水变浑浊,说明原固体中一定含有NaHCO3 | |
| D. | 取一定量固体,滴加0.l mol/L盐酸至1L时,溶液呈中性,说明固体中各物质的物质的量总和为0.05 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用镊子从试剂瓶中夹取钠块 | |
| B. | 用水清洗试管内壁附着的硫 | |
| C. | 采用“扇闻”的方法闻氯气的气味 | |
| D. | 用洁净的铂丝蘸取溶液进行焰色反应的实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 NH4HS溶液中有:c(NH4+)<c(HS-)+c(S2-)+c(H2S) | |
| B. | 在NaHSO4溶液中,c(H+)=c(OH-)+c(SO42-) | |
| C. | 等浓度的HCN和NaCN混合溶液中有:2c(Na+)=c(CN-)+c(HCN) | |
| D. | 等pH的①(NH4)2SO4溶液 ②NH4HSO4溶液 ③NH4Cl溶液中,c(NH4+)的大小关系:①>③>② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示,U形管内盛有200mL的溶液,按要求回答下列问题.
如图所示,U形管内盛有200mL的溶液,按要求回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子晶体中一定含有共价键,不含有离子键 | |
| B. | 仅含共价键的物质不一定是共价化合物 | |
| C. | 原子晶体中只存在非极性共价键 | |
| D. | 不同原子形成的纯净物一定是化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com