
【题目】配位化合物的数量巨大,组成和结构形形色色,丰富多彩。配合物[Cu(NH3)4](OH)2的中心离子、 配体和配位数分别为( )
A. Cu2+ 、NH3、4 B. Cu+、NH3、4
C. Cu2+ 、OH-、2 D. Cu2+ 、NH3、2
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】下列关于化学反应的说法正确的是( )
A.有单质生成的化学反应,一定是氧化还原反应
B.金属单质在氧化还原反应中只能作还原剂
C.有非金属单质参加的化合反应,非金属单质一定是氧化剂
D.有气体生成的化学反应一定是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上吸收工业尾气SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):

(1)Na2S2O4中S元素的化合价为________。
(2)写出装置Ⅱ中反应的离子方程式______________________________。
(3)装置Ⅲ中电解槽阴极发生的电极反应为_______________________________。
(4)从装置Ⅳ获得粗产品NH4NO3的实验操作依次为________、________、过滤、洗涤等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知[ZnCl4]2-中Zn2+的4s轨道和4p轨道形成sp3型杂化轨道,则[ZnCl4]2-的空间构型为
A. 直线形 B. 平面三角形
C. 平面正方形 D. 正四面体形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,错误的是
A. 非金属元素可能形成离子化合物
B. 成键原子间原子轨道重叠的愈多,共价键愈牢固
C. 对双原子分子来说,键能愈大,含有该键的分子愈稳定
D. 键长愈长,化学键愈牢固
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类最早使用的金属之一,中国使用铜的历史年代久远。大约在六、七千年以前中国人的祖先就发现并开始使用铜。纯铜是柔软的金属,呈紫红色,延展性好,导热性和导电性高,因此在电缆和电气、电子元件是最常用的材料,请回答下列问题:
(1)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是_______(填选项字母)
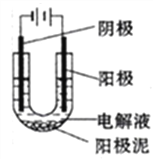
a.粗铜接电源正极,发生氧化反应
b.溶液中Cu2+向阴极移动
c.电解过程中,阳极和阴极的质量变化相等
d.利用阳极泥可回收Al、Zn等金属
(2)目前的电路板,主要由线路和图面组成,线路是作为原件之间导通的工具,在设计上会另外设计大铜面作为接地及电源层,在印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为______________。
(3) Cu不活泼,通常情况下不与稀硫酸反应,但向Cu和稀硫酸的混合物中滴入H2O2溶液后,溶液很快变蓝色,试写出该反应的离子方程式___________________。
(4)Cu2O中的Cu+不稳定,向Cu2O滴加稀硫酸,有紫红色物质生成,溶液变为蓝色,写出反应的离子方程式_________________。
(5)火法炼铜的原理:Cu2+O2![]() 2Cu+SO2,在改反应中每生成1molCu,转移________mole-。
2Cu+SO2,在改反应中每生成1molCu,转移________mole-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化砜(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2反应制取少量的SO2Cl2。装置如图(有些支持装置省略了)所示。

已知SO2Cl2的熔点为-54.1℃,沸点为69. 1℃;常温下比较稳定,受热易分解,遇水能发生剧烈的水解反应,产物之一为氯化氢气体。
(1)E中的试剂是饱和食盐水,戊是贮气装置, 则F瓶中气体的实验室制法是_________(用方程式表示);
(2)B处反应管冷却水应从__________(填“a”或“b”)接口通入;
(3)装置乙和丁的作用是____________;
(4)恒压漏斗具有特殊的结构,主要目的是___________;
(5)写出二氯化砜(SO2Cl2)水解反应的方程式________________;
(6)SO2溶于水生成亚硫酸,亚硫酸的酸性强于次氯酸,选用下面的装置和药品探究亚硫酸与次氯酸的酸性强弱:


装置连接顺序为A、_______、______、______、D、F,通过________________现象即可证明亚硫酸的酸性强于次氯酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有Na+、Al3+、Cl-、SO42-四种离子,已知前三种离子的个数比为3:2:1,则溶液中Al3+和 SO42-的离子个数比为
A.1:2 B.1:4 C.3:4 D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应方程式正确的是
A.氢氧化镁与盐酸的反应:H++OH-=H2O
B.碳酸氢钙和盐酸反应:HCO3-+H+=CO2↑+H2O
C.过量氢氧化钙与碳酸氢钠溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32—
D.Fe3O4溶于稀硫酸:Fe3O4+8H+=3Fe3++4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com