
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:

(1)除去粗盐中杂质(Mg2+、SO![]() 、Ca2+ ),加入的药品顺序正确的是______ ( 填字母);
、Ca2+ ),加入的药品顺序正确的是______ ( 填字母);
A.NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸
C.NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
D.Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
(2)制备钠单质的方法之一是将熔融NaCl进行电解,写出电解化学方程式:________________;
(3)步骤I中已获得Br2,步骤I中又将Br2还原为Br- ,其目的是_________________,写出步骤II中发生反应的化学方程式:_______________________;
(4)某化学小组的同学为了了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如下实验装置:

①图中仪器B的名称是_________________________________;
②C中收集到液体的颜色为__________________________________;
③Br2被过量Na2CO3溶液吸收的氧化产物为NaBrO3,则D中发生反应的化学方程式为_______________。
【答案】BC 2NaCl(熔融) ![]() 2Na+Cl2↑ 富集溴元素 Br2 +SO2+2H2O=2HBr+ H2SO4 直形冷凝管(或冷凝管) 深棕红色或红棕色 3Br2 +6Na2CO3 + 3H2O=NaBrO3+5NaBr + 6NaHCO3
2Na+Cl2↑ 富集溴元素 Br2 +SO2+2H2O=2HBr+ H2SO4 直形冷凝管(或冷凝管) 深棕红色或红棕色 3Br2 +6Na2CO3 + 3H2O=NaBrO3+5NaBr + 6NaHCO3
【解析】
海水淡化得到氯化钠,电解氯化钠溶液或熔融状态的氯化钠会生成氯气,氯气通入母液中发生反应得到低浓度的溴单质溶液,通入热空气吹出后用二氧化硫水溶液吸收得到含HBr和硫酸的溶液,再通入适量氯气氧化得到溴单质,富集溴元素,蒸馏得到工业溴,据此分析解答(1)~(3);
(4) 根据图示,从工业溴中提纯溴利用的原理是蒸馏,结合蒸馏的原理和碳酸钠的性质分析解答。
(1) 除去粗盐中杂质(Mg2+、SO![]() 、Ca2+),要先除SO
、Ca2+),要先除SO![]() 离子,然后再除Ca2+离子,碳酸钠可以除去过量的钡离子,如果加反了,过量的钡离子就没法除去,加NaOH除去Mg2+离子的顺序不受限制,将三种离子除完了,然后过滤,最后加盐酸除去过量的氢氧根离子和碳酸根离子即可,所以正确的操作顺序为:
离子,然后再除Ca2+离子,碳酸钠可以除去过量的钡离子,如果加反了,过量的钡离子就没法除去,加NaOH除去Mg2+离子的顺序不受限制,将三种离子除完了,然后过滤,最后加盐酸除去过量的氢氧根离子和碳酸根离子即可,所以正确的操作顺序为:
A.NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸,最后加入的氯化钡溶液中过量的钡离子无法除去,故A错误;
B.BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸,符合除杂原则,故B正确;
C.NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸,符合除杂原则,故C正确;
D.Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸,最后加入的氯化钡溶液中过量的钡离子无法除去,故D错误;故答案为:BC;
(2)制备钠单质的方法之一是将熔融NaCl进行电解,电解的化学方程式为:2NaCl(熔融)![]() 2Na+Cl2↑,故答案为:2NaCl(熔融)
2Na+Cl2↑,故答案为:2NaCl(熔融)![]() 2Na+Cl2↑;
2Na+Cl2↑;
(3) 因为低浓度的Br2溶液在提取时消耗过多的原料和能源,步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,目的是富集溴元素,步骤Ⅱ中二氧化硫吸收溴单质发生的反应为:Br2+SO2+2H2O═H2SO4+2HBr,故答案为:富集溴元素;Br2+SO2+2H2O═H2SO4+2HBr;
(4)①根据图示,提纯溴利用的原理是蒸馏,仪器B为冷凝管,故答案为:冷凝管;
②控制温度59℃,使溴单质挥发,通过冷凝得到呈深红棕色的液态溴单质,故答案为:深棕红色;
③Br2与过量Na2CO3反应生成NaBrO3、NaBr和NaHCO3,D中发生反应的化学方程式为3Br2+6Na2CO3+3H2O=NaBrO3+5NaBr+6NaHCO3,故答案为:3Br2+6Na2CO3+3H2O=NaBrO3+5NaBr+6NaHCO3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是 ( )

A.通电后中间隔室的SO42-向阳极迁移,阳极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.阴极反应为4OH--4e-=O2↑+2H2O,阴极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有11.2L O2生成(标况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流电池是一种新型储能电池,具有充放电可逆性高、能量转化效率高等优点,其结构如图所示,放电时电极a发生氧化反应。下列说法错误的是
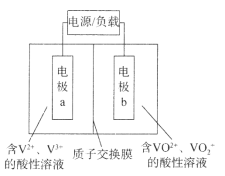
A.充电时电极a应连接电源的负极
B.放电时电极b发生的反应为![]() +e-+2H+=VO2++H2O
+e-+2H+=VO2++H2O
C.放电时电极a附近溶液pH不发生变化
D.充电时H+从质子交换膜右侧向左侧移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化。
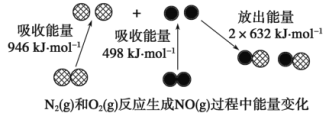
下列说法正确的是
A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ
B.1molN2(g)和1molO2(g)具有的总能量小于2molNO(g)具有的总能量
C.通常情况下,N2(g)和O2(g)混合能直接生成NO
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某原子结构示意图为 ,下列有关说法正确的是( )
,下列有关说法正确的是( )
A. 结构示意图中x=4
B. 该原子的电子排布式为1s22s22p63s23p4
C. 该原子的电子排布图为![]()
D. 该原子结构中共有5个能级上填充有电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,并回答下列问题:
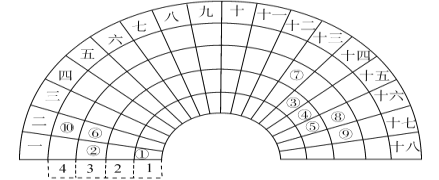
(1)若①~⑩分别代表十种元素,则⑩代表的元素处于常见周期表的位置是_______________________;
(2)⑥⑦为生活中两种常见的金属,其最高价氧化物对应水化物的碱性:⑥____⑦(填>、<或=);比较元素⑧⑨对应的常见单质氧化性的强弱,并用化学方程式证明:____________________________________;
(3)①③⑤三种元素形成的18电子结构化合物是近年来燃料电池研究领域的新宠,写出用它作燃料,②最高价氧化物对应的水化物作为电解质的燃料电池的负极反应式:___________________________;
(4)用电子式表示④的一种10电子结构氢化物的形成过程:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列离子晶体立体构型示意图如下图所示。


(1)以M代表阳离子,以N代表阴离子,写出各离子晶体的组成表达式。
A.__________,B:________,C:________,D:__________________________。
(2)已知FeS2晶体(黄铁矿的主要成分)具有A的立体结构。
①FeS2晶体中具有的化学键类型是__________________________________________。
②若晶体结构A中相邻的阴、阳离子间的距离为acm,且用NA代表阿伏加德罗常数,则FeS2晶体的密度是________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)上海白龙港污水处理厂升级改造,处理废水时加入明矾可作为混凝剂以吸附水中的杂质,利用漂白粉可用来杀菌消毒,工业上利用氯气和石灰乳制取漂白粉的化学反应方程式是___________,其中___________是漂白粉的有效成分;
(2)生产硅酸盐水泥和普通玻璃都需要用到的主要原料是__________(填名称);
(3)在雷电作用下,大气中游离态的氮会少量转化为化合态的氮并随雨水落下,这是自然中固定氮的途径之一。用化学方程式表示上述过程。________,_______,______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、实验室里用乙醇和浓硫酸反应生成乙烯,乙烯再与溴反应制1,2 -二溴乙烷。在制备过程中部分乙醇被浓硫酸氧化,产生CO2、SO2,并进而与溴反应生成HBr等酸性气体。
(1)用下列仪器,以上述三种物质为原料制备1,2一二溴乙烷。如果气体流向为从左到右,正确的连接顺序是(短接口或橡皮管均已略去):B经A①插人A中,D接A②;A③接_______接_____接_____接______。
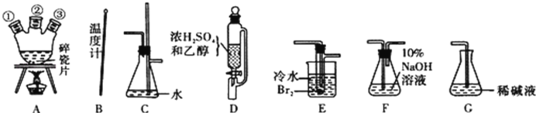
(2)装置C的作用是________________;
(3)在反应管E中进行的主要反应的化学方程式为____________________;
Ⅱ、某兴趣小组同学在实验室用加热l-丁醇、浓H2SO4和溴化钠混合物的方法来制备1-溴丁烷,设计了如下图所示的实验装置(其中的夹持仪器没有画出)。

请回答下列问题:
(1)两个装置中都用到了冷凝管,A装置中冷水从_________(填字母代号)进入,B装置中冷水从________(填字母代号)进入。
(2)制备操作中,加入的浓硫酸事先稍须进行稀释,其目的是________。(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成 c.水是反应的催化剂
(3)为了进一步提纯1-溴丁烷,该小组同学查得相关有机物的有关数据如下表:
物质 | 熔点/℃ | 沸点/℃ |
1-丁醇 | -89.5 | 117.3 |
1-溴丁烷 | -112.4 | 101.6 |
丁醚 | -95.3 | 142.4 |
1-丁烯 | -185.3 | -6.5 |
则用B装置完成此提纯实验时,实验中要迅速升高温度至_________收集所得馏分。
(4)有同学拟通过红外光谱仪鉴定所得产物中是否含有“-CH2CH2CH2CH3”,来确定副产物中是否存在丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)。请评价该同学设计的鉴定方案是否合理?________为什么?答:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com